Evidencia científica sobre las proteínas vegetales, calidad nutricional, efectos sobre la salud e impacto ambiental
Introducción
La proteína es un nutriente que ha tenido una tendencia cada vez más positiva en la mente de los consumidores, con una demanda creciente de fuentes de proteína tanto vegetales como animales [1]. Además, cada vez hay más pruebas clínicas, especialmente en los adultos mayores, que apoyan los beneficios para la salud asociados a las proteínas por encima de las recomendaciones actuales de ingesta de proteínas en la dieta. Entre estos beneficios para la salud se encuentran el aumento de la masa corporal magra [2],[3],[4],[5],[6], beneficios funcionales como el aumento de la potencia de las piernas [4] o la velocidad del andar [6], y la mejora de la densidad ósea [7],[8],[9]. Así pues, por un lado, es probable que haya un impulso continuo de opciones ricas en proteínas en el mercado alimentario. Por otro lado, la producción mundial de un mayor volumen de proteínas alimentarias, especialmente de proteínas animales de alta calidad, podría plantear problemas de sostenibilidad medioambiental. La producción de 1 kg de proteína animal de alta calidad requiere alimentar al ganado con 6 kg de proteína vegetal, lo que introduce la consiguiente presión sobre la tierra y los recursos hídricos, así como el potencial aumento de las emisiones de gases de efecto invernadero, asociados a la ganadería [1],[10]. Un uso más amplio y prudente de las proteínas vegetales en la dieta puede ayudar a suministrar proteínas adecuadas de alta calidad a la población y puede reducir el potencial de consecuencias medioambientales adversas. Esta revisión presenta información sobre: (1) la calidad nutricional de las proteínas vegetales; (2) las estrategias para el uso prudente de las proteínas vegetales con el fin de satisfacer las necesidades indispensables de aminoácidos; (3) los efectos de las proteínas vegetales en la salud y la función física; y (4) los posibles problemas de salud y seguridad asociados a las proteínas vegetales.
Determinación de la calidad de las proteínas
Dos requisitos para que una proteína se considere de alta calidad, o completa, para el ser humano son que tenga los niveles adecuados de aminoácidos indispensables (ver siguiente tabla) para favorecer el crecimiento y el desarrollo humanos y que se digiera y absorba fácilmente.
Aminoácidos indispensables, prescindibles y condicionalmente indispensables en la dieta humana. Adaptado de [11].
Tabla 1
| Indispensable | Peescindible | Condicionalmente Indispensable |
| Histidina | Alanina | Arginina |
| Isoleucina | Ácido aspártico | Cisteína |
| Leucina | Asparagina | Glutamina |
| Lisina | Ácido glutámico | Glicina |
| Metionina | Serina | Prolina |
| Fenilalanina | Tirosina | |
| Treonina | ||
| Triptófano | ||
| Valina |
A lo largo de los años se han desarrollado varios métodos para evaluar la calidad de las proteínas, pero la puntuación de aminoácidos es actualmente el método recomendado por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Academia Nacional de Ciencias de Estados Unidos [11],[12]. La puntuación de aminoácidos corregida por digestibilidad de la proteína (PDCAAS) fue desarrollada en 1989 por una consulta conjunta de expertos de la FAO y la OMS sobre la evaluación de la calidad de la proteína[13] para comparar el contenido de aminoácidos indispensables de una proteína de prueba (mg/g de proteína) con una proteína de referencia teórica que se cree que satisface los requisitos de aminoácidos indispensables (mg/g de proteína) para un grupo de edad determinado, creando una relación conocida como puntuación química o de aminoácidos. El aminoácido indispensable con la proporción más baja se denomina aminoácido más limitante. La puntuación del aminoácido más limitante se corrige en función de la verdadera digestibilidad fecal de la proteína.
Para determinar la verdadera digestibilidad fecal de la proteína, se alimenta a las ratas con una cantidad conocida de nitrógeno de la proteína de prueba y luego se mide la excreción fecal de nitrógeno [14]. Esta medida representa la digestibilidad proteica aparente. La excreción fecal de nitrógeno de las ratas con una dieta libre de proteínas se resta de la excreción fecal de nitrógeno de la proteína de prueba, que tiene en cuenta la excreción de nitrógeno proteico no dietético de las células bacterianas y las secreciones digestivas. El resultado se denomina digestibilidad proteica fecal verdadera. La ecuación de cálculo para el PDCAAS se muestra en la siguiente imagen.

Los resultados pueden expresarse como decimales o multiplicarse por 100 para expresarse como porcentaje. Un PDCAAS de 1,00 se truncan a 1,00.
En 2011, la FAO introdujo un sistema de puntuación de aminoácidos actualizado, la puntuación de aminoácidos digeribles indispensables (DIAAS) [16]. El DIAAS se calcula e interpreta de forma similar al PDCAAS, pero con algunas diferencias importantes. En primer lugar, los patrones de referencia para los aminoácidos indispensables se revisaron para reflejar los avances en el conocimiento científico sobre las necesidades de aminoácidos. En segundo lugar, ya no se utiliza una única estimación de la digestibilidad de las proteínas fecales. En su lugar, se incorporó el concepto de la digestibilidad ileal de aminoácidos individuales. La verdadera digestibilidad fecal de la proteína, que se basa en la excreción de nitrógeno en las heces, se complica por el considerable intercambio de proteína, aminoácidos y urea entre las reservas sistémicas y el tracto gastrointestinal inferior. En respuesta a esta limitación, se recomendó medir la digestibilidad ileal de los aminoácidos, que refleja la concentración de aminoácidos que llega al íleon y que, por tanto, entraría en el colon, derivada de los estudios de salida de la ileostomía realizados en animales o humanos. Así, cada aminoácido indispensable de una fuente proteica determinada tendrá un valor de digestibilidad ileal asociado y su puntuación de aminoácidos se corregirá en función de ese valor. Por último, a diferencia del PDCAAS, el método DIAAS permite puntuaciones >1,00 para reconocer que puede haber beneficios de salud incrementales asociados a estas puntuaciones DIAAS más altas.
La calidad de las proteínas vegetales
En general, la mayoría de las fuentes proteicas de origen animal, como la leche, el suero, la caseína, los huevos y la carne de vacuno, tienen PDCAAS iguales o muy cercanos a 1,00 [13],[17],[18]. Como tales, se consideran generalmente fuentes de proteínas completas para cubrir las necesidades de aminoácidos indispensables para el crecimiento y el desarrollo humanos. Sin embargo, las proteínas vegetales pueden tener niveles insuficientes de uno o más aminoácidos indispensables. Las legumbres suelen tener un bajo contenido en los aminoácidos que contienen azufre, como la metionina y la cisteína, mientras que la lisina suele ser limitada en los cereales [19]. Sin embargo, hay que tener en cuenta que las proteínas vegetales difieren en cuanto a las cantidades de aminoácidos limitantes que están presentes. La siguiente tabla muestra las clasificaciones PDCAAS y DIAAS para la proteína de la leche, el suero y varias fuentes de proteínas vegetales seleccionadas. Al igual que la proteína de la leche y el suero, la proteína de soja tiene esencialmente un PDCAAS de 1,00, y cuatro proteínas más (canola, patata, guisante y quinoa) tienen un PDCAAS de al menos 0,75.
Tabla 2
| Proteína | PDCAAS 1 | PDCAAS 2 | PDCAAS 3 | PDCAAS 4 | DIAAS 3 | Aminoácidos limitantes, cuando están presentes | Perfil AA: Materiales analizados y referencias | Digestibilidad fraccionada y referencias |
|---|---|---|---|---|---|---|---|---|
| Leche | 1.00 | 1.00 | 1.00 | 1.00 | 1.08 | Ninguno | Leche PC [20],[21] | Proteína fecal verdadera: media 0,96 [13],[20] AA ileal: rango de AA individual 0,84-0,94 [22] |
| Suero de leche | 1.00 | 1.00 | 0.97 | 1.00 | 0.90 | His | Suero de leche PI [20],[21],[23] Suero de leche PC [20],[21] |
Proteína fecal verdadera: media 0,96 [20],[24] AA ileal: rango de AA individual 0,89-1,00 [22] |
| Soja | 0.99 | 1.00 | 0.93 | 1.00 | 0.92 | SAA | Soja PI, Soja PC [25] Soja PI [20] Soja PI [21] |
Proteína fecal verdadera: media 0,97 [13],[20],[21],[25] AA ileal: rango de AA individual 0,95-0,99 [22] |
| Canola | 0.88 | 1.00 | 0.93 | 1.00 | NA | AAA | Canola PI [26]; Canola PI [27] |
Proteína fecal verdadera: media de 0,95 [26],[27] |
| Papa | 0.87 | 1.00 | 0.87 | 1.00 | 0.85 | His | Solanic 100F Papa PI [28] Solanic 206P HMW y LMW [29] Proteína de papa [30] Concentrado de proteína de jugo de papa [31] Avg de 6 variedades de papa [32] |
Proteína fecal verdadera: 0,89 [24] AA ileal: rango de AA individual 0,73-0,90 [22] |
| Arveja | 0.83 | 0.84 | 0.78 | 0.91 | 0.66 | SAA *, Trp | Arveja PC [33] Arveja PC [21] Arveja PC [20] |
Proteína fecal verdadera: media 0,97 [20],[21],[33] AA ileal: rango de AA individual 0,83-0,90 [20] |
| Quinoa | 0.78 | 0.89 | 0.77 | 0.84 | NA | Ile, Leu, Lys *, Thr, Val | Quinoa cruda [34] Quinoa [35] Quinoa salteña [36] Quinoa cruda [37] Quinoa cultivada en el campo [38] Quinoa cruda y sin lavar [39] |
Proteína fecal verdadera: media 0,89 [39],[40] |
| Garbanzo | 0.77 | 0.85 | 0.71 | 0.71 | 0.69 | Leu, Lys, SAA *, Thr, Trp, Val | Garbanzos cocidos [41] | Proteína fecal verdadera: 0,85 [42] Ilea AA: rango de AA individual 0,72-0,9 [22] |
| Lentejas | 0.73 | 0.73 | 0.68 | 0.80 | 0.75 | Leu, SAA *, Thr, Trp, Val | Lentejas, semillas maduras, ckd, bld sin sal [37] | Proteína fecal verdadera: 0,85 [24] AA ileal: rango de AA individual 0,82-0,98 [22] |
| Alubias rojas | 0.68 | 0.68 | 0.63 | 0.74 | 0.61 | Leu, Lys, SAA *, AAA, Thr, Trp, Val | Frijoles rojos, cnd, sólidos drnd [37] | Proteína fecal verdadera: 0,81 [24] AA ileal: rango de AA individual 0,72-0,94 [22] |
| Haba | 0.63 | 0.65 | 0.60 | 0..67 | NA | Lys, SAA *, Thr, Trp, Val | Habas PI [43] Habas cocidas [44] Habas, ckd [37] 8 cultivares de faba [45] PI de habas [46] |
Proteína fecal verdadera: 0,86 [47] |
| Cebada | 0.63 | 0.71 | 0.64 | 0.76 | 0.50 | Lys * | Cebada perlada [48] | Proteína fecal verdadera: 0,98 [49] AA ileal: rango de AA individual 0,76-0,83 [22] |
| Alubias pintas | 0.61 | 0.61 | 0.57 | 0.66 | NA | His, Ile, Leu, Lys, SAA *, AAA, Thr, Trp, Val | Frijoles pintos, cnd, sólidos drnd [37] | Proteína fecal verdadera: 0,73 [24] |
| Arroz | 0.53 | 0.60 | 0.54 | 0.64 | 0.52 | Lys *, Thr | Arroz PC [50] Proteína de endospermo de arroz [51] Oryzateína 90 y 80 Proteína de arroz [52] PC de arroz [21] |
Proteína fecal verdadera: media 0,90 [21],[24],[51] AA ileal: rangos medios de AA individuales 0,81-0,87 [21],[22] |
| Avena | 0.51 | 0.59 | 0.52 | 0.62 | 0.44 | Lys *, Thr | Avena PC [53]; Copos de avena [21] |
Proteína fecal verdadera: 0,91 [13] AA ileal: rango de AA individual 0,70-0,85 [22] |
| Maní | 0.46 | 0.52 | 0.47 | 0.55 | 0.47 | Ile, Leu, Lys *, SAA, Thr, Trp, Val | Maní PC y PI [54] Maní tostado [21] |
Proteína fecal verdadera: 0,93 [24] AA ileal: rangos medios de AA individuales 0,82-0,96 [21],[22] |
| Trigo | 0.45 | 0.51 | 0.46 | 0.54 | 0.39 | Ile, Leu *, Lys *, AAA, Thr *, Val | Harina integral y blanca [55] Salvado de trigo [21] |
Proteína fecal verdadera: media de 0,94 [24] AA ileal: rangos medios para AA individuales 0,81-0,91 [22] (salvado de trigo, harina de trigo, gluten de trigo, trigo) |
| Maíz | 0.41 | 0.47 | 0.42 | 0.50 | 0.38 | Ile, Lys *, SAA, Thr *, Trp*, Val | Harina de maíz [56] Tortillas de maíz [57] |
Proteína fecal verdadera: 0,84 [24] AA ileal: rangos para el AA individual 0,75-0,88 [22] |
Aunque el PDCAAS de la mayoría de las proteínas vegetales puede ser inferior a 1,00, el sistema de puntuación de proteínas individualizado es sólo una forma de evaluar las contribuciones potenciales de una proteína a la dieta. Canadá utiliza un método basado en la Relación de Eficiencia Proteica (PER), que es un ensayo de crecimiento/ganancia de peso en ratas alimentadas con diferentes fuentes de proteínas. Health Canada proporciona una lista de valores de PER para diferentes alimentos proteicos en su sitio web y sugiere que el PER de una fuente de proteína puede estimarse multiplicando el PDCAAS por 2,5 [58]. Hay otros factores que pueden aumentar la contribución potencial de las proteínas de origen vegetal para satisfacer las necesidades generales de proteínas y aminoácidos indispensables en la dieta. Un aspecto a tener en cuenta es la cantidad de proteína dietética aportada por una fuente de proteína vegetal específica. En el caso de las proteínas de origen vegetal frente a las de origen animal, el simple hecho de consumir más proteínas de origen vegetal puede contribuir a aumentar la ingesta de aminoácidos indispensables. Dado que muchas fuentes de proteína vegetal son menos calóricas que las fuentes de proteína animal, se necesita una mayor ingesta total de alimentos para satisfacer las necesidades energéticas, lo que a su vez ayuda a satisfacer las necesidades de aminoácidos indispensables.
La variedad de proteínas en la dieta también es clave para satisfacer las necesidades de aminoácidos indispensables. Mientras que el PDCAAS de una proteína individual es crítico a la hora de evaluar la calidad de una proteína de fuente única, se vuelve menos significativo cuando la dieta contiene proteínas de muchas fuentes. Por ejemplo, la lisina suele ser limitante en las proteínas de los cereales, pero estas proteínas son buenas fuentes de los aminoácidos que contienen azufre. Por otro lado, las legumbres suelen ser fuentes ricas en lisina pero son limitantes en aminoácidos que contienen azufre. El consumo de estas dos fuentes de proteínas a lo largo del día permite que se "complementen" entre sí, ayudando a satisfacer las necesidades de ambos tipos de aminoácidos indispensables. Un ejemplo clásico sería una combinación de proteínas de guisante y arroz. Las mezclas de proteínas de guisante y arroz que oscilan entre el 40 y el 90% de proteínas de guisante pueden alcanzar un PDCAAS de 1,00, utilizando el patrón de referencia de aminoácidos de la FAO para adultos de 2011 [16].
Una cuestión que ha surgido para los vegetarianos es si es necesario combinar fuentes de proteínas complementarias en la misma comida. Young y Pellet [19] abordaron esta cuestión. Observaron que el aminoácido limitante común en los cereales, la lisina, tiene una reserva importante en el músculo esquelético. Después de una comida rica en proteínas, estimaron que el 60% de las necesidades diarias de lisina de un adulto podría almacenarse en esta reserva en un plazo de 3 horas. Si una persona consumiera una comida pobre en lisina en las 3 horas siguientes a una comida rica en lisina, seguiría habiendo suficiente lisina intracelular disponible para promover la síntesis de proteínas. Por lo tanto, no es necesario consumir fuentes de proteínas complementarias en la misma comida si el intervalo entre las comidas es relativamente corto, alrededor de 3 horas; los aminoácidos complementarios estarán metabólicamente disponibles para la síntesis de proteínas.
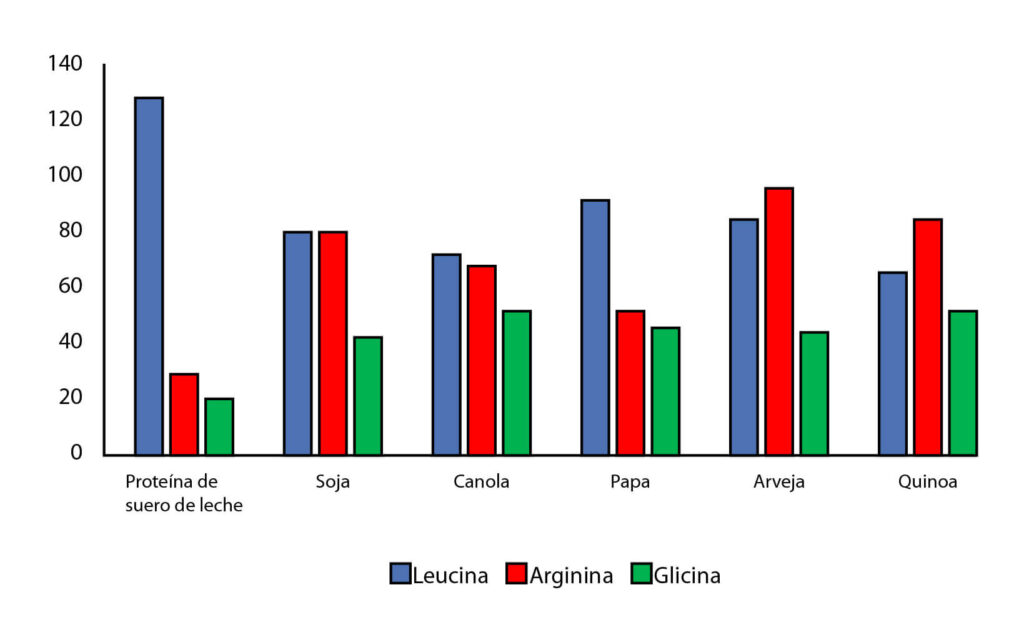
Un aspecto de las proteínas vegetales que a menudo se descuida es su alto contenido en algunos aminoácidos importantes prescindibles/condicionalmente indispensables. El método PDCAAS de evaluación de la calidad de las proteínas se centra únicamente en los aminoácidos indispensables y, en general, en las necesidades proteicas de todo el organismo. Sin embargo, desde el desarrollo del concepto PDCAAS, la base de conocimientos en torno a los efectos relacionados con la salud o el rendimiento de los aminoácidos individuales, tanto indispensables como condicionalmente indispensables, ha crecido de forma espectacular. Por ejemplo, la proteína de suero de leche ha recibido mucha atención para la construcción de músculo debido a su alto nivel de leucina, que sirve como señal nutritiva para iniciar el proceso de síntesis de proteínas musculares [59],[60]. Sin embargo, es importante no olvidar las funciones fisiológicas vitales de los aminoácidos prescindibles/condicionalmente indispensables que se encuentran en grandes cantidades en las proteínas vegetales. La proteína de soja, aunque no es tan alta como la del suero de leche en leucina, es casi tres veces más alta en arginina, 2-3 veces más alta en glutamina y tiene el doble de contenido en glicina (Figura 2 y Tabla 3). Otras proteínas vegetales también pueden tener un alto contenido en estos aminoácidos. La arginina es necesaria para la síntesis corporal de óxido nítrico (vasodilatador) y creatina, para la función del ciclo de la urea, para la regulación de la secreción hormonal y para la función inmunitaria [61],[62]. La glutamina es una fuente primaria de combustible para las células de rápida proliferación, como las del sistema inmunitario y el tracto gastrointestinal, y participa en la síntesis de arginina, ornitina y otros compuestos [61], [63]. La glicina es fundamental para la síntesis de colágeno, ya que constituye hasta 1/3 de los aminoácidos del colágeno, y algunos estudios sugieren que su biosíntesis en los seres humanos puede no ser adecuada para satisfacer las necesidades [64],[65],[66],[67]. Aunque aminoácidos como la arginina, la glutamina y la glicina podrían no ser clasificados siempre como aminoácidos indispensables, desempeñan muchas funciones críticas y las proteínas vegetales pueden ser fuentes importantes. Por lo tanto, el contenido de estos aminoácidos prescindibles/condicionalmente indispensables merece ser tenido en cuenta al evaluar el valor de las proteínas vegetales en la dieta.
| Proteína | Concentración de glutamina (mg/g de proteína, media) | Concentración de glutamina (mg/g de proteína, rango) |
| Hidrolizado de proteínas de trigo (n = 15) | 296 | 184–402 |
| Aislado de proteína de trigo (n = 2) | 208 | 184–232 |
| Proteína de maíz (n = 1) | 196 | -- |
| Proteína de arroz (n = 1) | 130 | -- |
| Caseína (n = 2) | 102 | 100–104 |
| Aislado de proteína de soja (n = 2) | 100 | 94–106 |
| Concentrado de proteína de soja (n = 1) | 94 | -- |
| Concentrado de proteínas lácteas (n = 1) | 94 | -- |
| Concentrado de proteína de suero (n = 2) | 57 | 550–63 |
| Aislado de proteína de suero con intercambio iónico (n = 1) | 34 | -- |
Concentración de glutamina en proteínas vegetales y lácteas seleccionadas. Fuentes de datos: Referencias [68],[69],[70],[71]
Importancia de las proteínas vegetales en la salud
Los beneficios de las proteínas vegetales para la salud y las enfermedades crónicas a largo plazo han sido un tema de tendencia en los últimos años. Esta sección resume algunas de las pruebas y revisiones analíticas más recientes para varias áreas de la salud, como la salud cardiovascular, el síndrome metabólico, la diabetes, el cáncer, la función renal, la masa corporal magra y la fuerza, así como la morbilidad y la mortalidad en general.
Proteínas vegetales, enfermedades cardiovasculares y factores de riesgo metabólico
Numerosos estudios han explorado el impacto potencial que las proteínas vegetales de la dieta tienen en la reducción de los factores de riesgo cardio-metabólico. Uno de los primeros informes que sintetizó los resultados de la ingesta de proteínas vegetales como sustitución de las proteínas animales fue un estudio publicado en 2017. En esta revisión sistemática y meta-análisis de 112 ensayos clínicos aleatorios a través de adultos con y sin hiperlipidemia, los autores demostraron una reducción de los marcadores de enfermedad cardiovascular a favor del consumo de proteína vegetal sobre el de proteína animal [72]. Los autores informaron de una reducción de los lípidos sanguíneos en todos los estudios, incluyendo una disminución del colesterol de lipoproteínas de baja densidad, del colesterol de lipoproteínas de baja densidad y de la apolipoproteína B. Aunque los autores pidieron que se realizaran ensayos aleatorios de mayor calidad para confirmar sus resultados, estas pruebas apoyan la proteína vegetal como una sustitución eficaz de la proteína animal en la dieta para ayudar a reducir los factores de riesgo de enfermedades cardiovasculares en adultos. Se realizó un metaanálisis más reciente sobre el impacto de las proteínas vegetales en comparación con las proteínas animales en 32 ensayos de intervención en pacientes hipercolesterolémicos [73]. Aunque había pruebas a favor de las proteínas vegetales para reducir los perfiles lipídicos, la mayoría de los ensayos de este análisis examinaron los productos de soja como intervención en comparación con una variedad de fuentes de proteínas animales. Por lo tanto, puede ser difícil sacar una conclusión amplia sobre todas las proteínas vegetales basándose en los limitados tipos de estudios sobre proteínas vegetales.
También se han descrito los beneficios de las proteínas vegetales y la salud metabólica en poblaciones adolescentes. La obesidad es un problema creciente en todo el mundo entre los adolescentes, y varios estudios han examinado los posibles beneficios de la ingesta de proteínas vegetales en relación con la obesidad, el control del peso o el síndrome metabólico. Uno de ellos fue el estudio Healthy Lifestyle in Europe by Nutrition in Adolescence (HELENA), un estudio transversal de adolescentes europeos [74]. En este estudio, tanto la ingesta de proteínas totales como la de proteínas animales eran mayores en los adolescentes obesos. Los adolescentes que consumían mayores niveles de proteínas vegetales presentaban menores porcentajes de grasa corporal e IMC en comparación con los adolescentes que consumían más proteínas animales. Sin embargo, las proteínas son fundamentales para muchas funciones fisiológicas y facetas del desarrollo, y es importante una ingesta adecuada de proteínas. El estudio sugirió aumentar las proteínas vegetales en las dietas de los adolescentes como sustitución de las proteínas animales para ayudar a controlar la obesidad y por sus posibles beneficios positivos para los factores cardiometabólicos [74]. La incorporación de más proteínas vegetales en la dieta para sustituir el exceso de calorías y proteínas animales puede ser una estrategia útil para ayudar a la obesidad de los adolescentes.
Sin embargo, algunos investigadores han criticado el intento de hacer afirmaciones generales sobre la superioridad de los beneficios para la salud cardiometabólica de las proteínas vegetales frente a las proteínas animales. Aunque se han descrito las ventajas de las fuentes alimentarias vegetales, los investigadores aconsejan no considerar indiscriminadamente que todas las proteínas animales son inferiores a las vegetales para la salud cardiovascular, citando pruebas limitadas e inconsistentes que apoyan ese tipo de conclusión [75],[76]. En un editorial, Campbell advirtió que no todos los estudios han demostrado un efecto perjudicial de la carne roja en comparación con las proteínas vegetales sobre los marcadores de riesgo de enfermedades cardiovasculares y sugirió que existen pruebas contradictorias a la hora de evaluar la carne blanca en comparación con la carne roja como una opción animal más saludable [75]. Por ejemplo, el ensayo aleatorizado, cruzado y controlado de Bergeron et al. [77] encontró un beneficio de la ingesta de proteínas no cárnicas frente a la ingesta de proteínas animales, pero ninguna diferencia entre la carne blanca frente a la carne roja en los períodos de dieta de proteínas animales. Los autores del estudio concluyeron que debería introducirse más proteína de origen vegetal en la dieta para reducir el riesgo de enfermedades cardiovasculares, pero señalaron que su corto periodo de intervención y la incapacidad de mostrar una diferencia entre varias dietas de proteína animal pueden limitar la interpretación de los resultados.
Proteínas vegetales y diabetes
Aunque las dietas vegetarianas se asocian a una reducción sustancial del riesgo de diabetes [78] , no está claro si la sustitución de la proteína animal por la vegetal contribuye a impulsar esta reducción del riesgo. Malik et al. [79], analizando los datos del Nurses' Health Study II, descubrieron que la sustitución de la proteína animal por un 5% de la ingesta energética procedente de la proteína vegetal se asociaba a una reducción del 23% del riesgo de diabetes de tipo 2. Una ingesta de 20 g de proteína de arvejas amarillas, servida en una sopa de tomate 30 minutos antes de comer una pizza, redujo la respuesta glucémica a la pizza y la ingesta energética de la misma (en comparación con la sopa de tomate) [80]. En un estudio similar, se comparó un desayuno de 400 kcal que incluía una bebida sustitutiva de una comida que contenía unos 29 g de proteína de soja con un desayuno isocalórico, de mayor índice glucémico y con menos proteínas. La bebida de proteína de soja se asoció con (1) una menor respuesta glucémica postprandial (niveles de azúcar en la sangre después de haber ingerido comida) y de grelina al desayuno; y (2) una menor secreción de insulina postprandial de un almuerzo estandarizado ingerido 4 horas después [81].
En un metaanálisis de 2015 de ensayos de control aleatorios que sustituyeron las fuentes de proteína animal por proteína vegetal en al menos un 35% de la ingesta total de proteínas en la dieta durante una duración media del estudio de ocho semanas, los autores informaron de mejoras significativas, aunque modestas, en los niveles de HbA1c, glucosa en ayunas e insulina en ayunas en individuos con diabetes [82]. Estos resultados fueron positivos, pero se observaron limitaciones. Los autores pidieron que se realizaran ensayos clínicos más largos y de mayor tamaño para confirmar los resultados, ya que el tamaño de las muestras era relativamente pequeño en los estudios revisados. También hay que tener en cuenta que el metaanálisis incluyó estudios notificados para poblaciones de diabéticos de tipo 1 y de tipo 2.
Desde que se realizó este meta-análisis en 2015, un ensayo clínico prospectivo evaluó los beneficios potenciales de las dietas altas en proteínas utilizando fuentes de proteínas vegetales o animales en individuos adultos (de 64,3 ± 1 años) con diabetes tipo 2. Este estudio clínico aleatorio de 37 individuos diabéticos sometidos a una dieta alta en proteína animal (80,2% de la proteína total en la intervención) o a una dieta alta en proteína vegetal (72,3% de la proteína total en la intervención) durante seis semanas encontró que ambas dietas redujeron de manera similar el peso corporal, el IMC, la HbA1c y los marcadores de lípidos en sangre después de la intervención [83]. El grupo de proteína animal experimentó una disminución de la glucosa en ayunas y de la sensibilidad a la insulina en todo el cuerpo con respecto al valor inicial, pero no hubo diferencias entre los grupos de proteína. Otros análisis de los resultados de este ensayo revelaron respuestas similares de ambos grupos de intervención en cuanto a la grasa hepática, los marcadores de inflamación hepática y la resistencia a la insulina [84]; los biomarcadores de estrés oxidativo [85]; y las citoquinas proinflamatorias [83]. Otros estudios tampoco han podido demostrar el beneficio de una dieta vegetariana frente a las dietas con proteínas animales para los individuos con diabetes. En un ensayo controlado aleatorio en pacientes con diabetes de tipo 2, no se observaron beneficios ni diferencias en los biomarcadores cardiometabólicos en los tres grupos asignados al azar a una dieta de proteínas de carne roja, a una dieta de proteínas de legumbres de soja o a una dieta de proteínas de legumbres sin soja después de ocho semanas [86]. Los autores concluyeron que el impacto de la dieta completa podría ser más relevante que el impacto de la fuente de proteína, y que la proteína animal podría consumirse como parte de una dieta equilibrada. Se justifica la realización de estudios más amplios y a más largo plazo en individuos con diabetes.
Consumo de proteínas vegetales e incidencia del cáncer
Otra área de interés para examinar los beneficios de aumentar la ingesta de proteínas vegetales en lugar de proteínas animales es la reducción del riesgo de cáncer. Ciertamente, el riesgo de desarrollar cáncer está influenciado por múltiples factores, como la predisposición genética, el medio ambiente y los hábitos dietéticos y de estilo de vida. Un grupo se ha centrado en examinar el riesgo de cáncer colorrectal en individuos utilizando análisis de interacción gen-ambiente, incorporando varios factores de estilo de vida, factores genéticos y riesgo de cáncer [87]. En su examen de una gran cohorte prospectiva danesa, los autores informaron de una asociación entre ciertos polimorfismos genéticos para el metabolismo de los ácidos grasos y el cáncer colorrectal, que se asociaron además con un elevado consumo de carne. Describieron que el consumo elevado de carne se asociaba a un alto riesgo de cáncer colorrectal entre algunos portadores del gen en comparación con los que tenían el mismo polimorfismo genético y consumían dietas con menor consumo de carne [87]. Por lo tanto, la sustitución de la proteína animal por proteína vegetal en la dieta puede ser una estrategia para reducir el riesgo de cáncer colorrectal en individuos con ciertas variantes genéticas. Sin embargo, se han obtenido resultados contradictorios en cuanto a si el cambio de proteína animal a más proteína vegetal reducirá el riesgo de cáncer colorrectal. Por ejemplo, un estudio reciente incluyó a 79 adultos prediabéticos en una intervención dietética de un año para perder peso [88]. Este estudio examinó la ingesta total de proteínas en la dieta, la ingesta de carne roja y la proporción de proteínas animales y vegetales. Al inicio y después de la intervención de un año, estos hábitos dietéticos se compararon con el nivel de concentraciones de amoníaco fecal, un biomarcador del riesgo de cáncer colorrectal. Aunque este estudio informó de una asociación dependiente de la dosis entre la concentración de amoníaco fecal y la cantidad de ingesta de carne roja, no hubo asociaciones entre el amoníaco fecal y la ingesta total de proteínas o la proporción de proteínas animales y vegetales en estos individuos [88].
En la revisión de la literatura, había pocas pruebas que confirmaran los beneficios de la proteína vegetal por encima de la proteína animal en cuanto a su impacto en la reducción del riesgo de cáncer. Es probable que esta sea un área de interés creciente para futuras investigaciones con el fin de comprender mejor si la proteína vegetal en sí misma confiere algún beneficio o si la adopción de mejores hábitos dietéticos asociados con el aumento de la ingesta de proteína vegetal ayuda a impulsar resultados de salud.
Las proteínas vegetales como alimentos funcionales
Las proteínas vegetales también se han estudiado por su potencial como alimentos funcionales. Se han realizado numerosos estudios para examinar su impacto en el riesgo cardiovascular, la glucemia o la saciedad. Muchos estudios se han centrado en las propiedades funcionales y bioactivas de la proteína de soja, especialmente para reducir el riesgo de enfermedades cardiovasculares, modular la inflamación o modular el sistema inmunitario Las proteínas vegetales también se han estudiado por su potencial como alimentos funcionales. Se han realizado numerosos estudios para examinar su impacto en el riesgo cardiovascular, la glucemia o la saciedad. Muchos estudios se han centrado en las propiedades funcionales y bioactivas de la proteína de soja, especialmente para reducir el riesgo de enfermedades cardiovasculares, modular la inflamación o modular el sistema inmunitario [89]. Una reciente revisión sistemática examinó las propiedades bioactivas de las fuentes de proteína vegetal distintas de la soja, incluidas las proteínas de guisante, lupines, haba, arroz, avena, cáñamo y lenteja [90]. La mayoría de los ensayos informaron de los beneficios de los ingredientes de proteína vegetal examinando las concentraciones postprandiales de glucosa en sangre, insulina y/o hormonas reguladoras del apetito. Aunque hubo heterogeneidad en los resultados, los estudios que compararon la proteína animal con la vegetal no mostraron ningún beneficio de la proteína vegetal en la regulación de la glicemia postprandial. Asimismo, los beneficios de la proteína vegetal como alimento funcional para la saciedad mostraron resultados contradictorios, aunque la proteína de guisante podría tener algún beneficio. Es probable que los componentes bioactivos de una dieta vegetal se atribuyan a menudo a las fuentes de alimentos enteros más que a las proteínas aisladas. Es bien sabido que numerosos componentes de las plantas, como los carotenoides y los flavonoides, confieren beneficios bioactivos para la salud. Sin embargo, es necesario seguir investigando sobre las proteínas vegetales y los péptidos bioactivos.
La ingesta de proteínas vegetales y su relación con la mortalidad
Muchos estudios también han relacionado las fuentes de ingesta de proteínas con la mortalidad. Una publicación reciente de la gran cohorte prospectiva del Estudio de Dieta y Salud de los NIH-AARP también examinó el impacto de la elección de proteínas en la dieta sobre la mortalidad [91]. En este estudio, se realizó un seguimiento de 617.199 personas de entre 50 y 71 años en todo Estados Unidos desde 1995 o 1996 hasta el seguimiento del estudio en diciembre de 2011. La ingesta de proteína vegetal se asoció de forma significativa e inversa con la mortalidad por todas las causas, así como con la mortalidad por causas específicas de enfermedades cardiovasculares y accidentes cerebrovasculares, tanto en hombres como en mujeres. Informaron de que la sustitución de tan solo un 3% de la ingesta de proteínas animales por proteínas vegetales se asociaba a una reducción del 10% de la mortalidad general tanto en hombres como en mujeres [91]. Estos resultados son coherentes con una reciente revisión sistemática y un meta-análisis sobre el impacto de la ingesta de proteínas en el riesgo de mortalidad [92]. En consonancia con otros informes que destacan la importancia de aumentar la ingesta de proteínas vegetales, especialmente a medida que envejecemos, una mayor ingesta de proteínas totales se asoció con una reducción del riesgo de mortalidad por todas las causas. Sin embargo, la estratificación de los datos en función de la ingesta de proteínas animales o vegetales reveló un menor riesgo de mortalidad por todas las causas en el caso de las dietas con proteínas vegetales. En el metanálisis se analizaron diez estudios que examinaban la ingesta de proteínas animales o vegetales para determinar la asociación con la mortalidad por enfermedades cardiovasculares. Mientras que no hubo una asociación clara entre la ingesta de proteínas animales y la mortalidad, se encontró una asociación inversa entre la ingesta de proteínas vegetales y el riesgo de enfermedades cardiovasculares. Estos estudios apoyan el beneficio de sustituir las proteínas animales por proteínas vegetales en la dieta en términos de longevidad y mortalidad.
Efecto renoprotector de las proteínas vegetales
La dieta estadounidense se caracteriza típicamente por ser baja en frutas, verduras, lácteos y aceites saludables y por exceder las recomendaciones de granos totales, alimentos proteicos totales, azúcares añadidos, grasas saturadas y sodio [93]. Esta dieta, también caracterizada como dieta occidental, ha estado bajo escrutinio para establecer las diferencias metabólicas que contribuyen a la enfermedad crónica, especialmente en lo que respecta a la enfermedad renal crónica (ERC) [94]. Pruebas epidemiológicas recientes sugieren que no sólo la cantidad de proteínas, sino también su origen (por ejemplo, vegetal o animal), pueden ser un factor que influye en la función renal [95]. Los matices de experimentos anteriores con una ingesta de proteínas baja frente a la normal recomendada dieron pistas sobre el impacto potencial del origen de las proteínas. Viberti et al. [96] sustituyeron la proteína animal de una dieta isocalórica por fuentes vegetales en un estudio cruzado con adultos sanos y observaron una reducción de la tasa de filtración glomerular (TFG) [análisis de sangre que evalúa el funcionamiento los riñones. La prueba de TFG estima cuánta sangre pasa por minuto a través de estos filtros] y del flujo plasmático renal (FPR) [cantidad de plasma que atraviesa los riñones]. Un subestudio dentro de una investigación más amplia que se diseñó para examinar el efecto de las proteínas alimentarias en la TFG comparó a sujetos sanos vegetarianos con los que seguían una dieta omnívora. Ambos grupos consumieron sus dietas normales. El nivel medio de creatinina en plasma no fue significativamente diferente entre los grupos, pero el aclaramiento de creatinina [es una prueba de laboratorio que se hace con el fin de monitorizar el funcionamiento de los riñones. Sirve para valorar el grado de insuficiencia renal.] fue significativamente menor en el grupo vegetariano [97]. En un estudio de pacientes con diabetes de tipo 1 con nefropatía en fase inicial, [La nefropatía diabética es una complicación común de la diabetes tipo 1 y tipo 2. Con el tiempo, la diabetes mal controlada puede causar daño a los grupos de vasos sanguíneos en los riñones que filtran los desechos de la sangre. Esto puede causar daño renal y presión arterial alta] se observó que una dieta rica en proteínas de soja reducía la hiperfiltración glomerular [98]. El aumento de la TFG y la hiperfiltración glomerular contribuyen a la incidencia de la lesión renal e indican cómo la dieta puede tener un impacto negativo en la función renal [99].
El efecto de la ingesta de proteínas vegetales y animales en la función renal sigue siendo objeto de estudio. En un análisis prospectivo de una gran cohorte (n = 15.055) del estudio Atherosclerosis Risk in Communities (ARIC) [100], la carga de ácido renal en la dieta se asoció positivamente con la incidencia de la enfermedad renal crónica (ERC) (definida por los autores como una reducción del 25% de la tasa de filtración glomerular estimada (TFGe), la hospitalización relacionada con la ERC, la enfermedad renal terminal o la mortalidad). Esto refleja los resultados de un estudio de cohorte longitudinal de 10 años en el que el objetivo era evaluar el origen de la ingesta de proteínas en una cohorte de mujeres mayores y la posible relación con la incidencia de la tasa de deterioro de la función renal relacionada con la edad. Un mayor consumo de proteínas vegetales se relacionó con un descenso más lento de la TFGe, pero la ingesta de proteínas animales no se asoció con el descenso de la función renal [95]. En dos estudios de intervención de un año de duración, los pacientes con ERC en estadio 3 o 4 fueron tratados con bicarbonato sódico o con frutas y verduras en dosis para reducir la carga de ácido renal, un hipotético factor de riesgo metabólico de daño renal, en un 50% [101],[102]. Ambos tratamientos mejoraron la acidosis metabólica y los índices de lesión renal y lo hicieron sin producir hiperpotasemia. En otro ensayo, los participantes que seguían dietas con un contenido de nutrientes equivalente presentaban una menor cantidad de fósforo sérico y de excreción de fósforo cuando la fuente de proteínas era vegetariana en comparación con la de origen animal [103]. Los resultados observacionales del Estudio de Cohorte de Insuficiencia Renal Crónica apoyaron estos hallazgos para indicar que existe una asociación entre el consumo de proteínas vegetales y la reducción de los factores de riesgo metabólico de la ERC [104]. La totalidad de estas pruebas apuntan al beneficio de las proteínas vegetales en la dieta para disminuir el impacto de la ingesta de proteínas en pacientes con mayores necesidades proteicas, debido al desgaste, por la hiperfiltración glomerular.
Las proteínas vegetales del endospermo de la soja y del arroz han demostrado tener propiedades protectoras del riñón en modelos de ratas diabéticas [105]. Un posible mecanismo de acción del efecto renoprotector de las proteínas vegetales es un efecto indirecto mediado por la mejora de la homeostasis de la glucosa, ya que la ingesta de proteínas vegetales se asocia a una reducción del desarrollo del hígado graso. Otra posible explicación es que una proteína como la del endospermo de arroz tiene un alto contenido en arginina, un precursor del óxido nítrico (NO), que está agotado en este modelo de rata [105],[106]. La mejora de la hemodinámica renal que resulta de la suplementación de arginina podría ser el resultado directo de un aumento de la producción de (NO) [106]. Estas fuentes de proteínas vegetales aportan compuestos adicionales a la mezcla que también hay que tener en cuenta, como las isoflavonas de soja, que podrían afectar a la función renal a través de acciones de señalización celular y la producción de óxido nítrico que afectan a la perfusión renal [107]. El consumo de soja también se ha asociado a mejoras en el estado antioxidante y la inflamación sistémica en pacientes con ERC [107]. Dicho de otro modo, hay que tener en cuenta todo el "paquete de proteínas" en términos de beneficios para la salud. Los efectos de la soja en la función renal podrían ser el resultado del impacto de todo el alimento en los factores de riesgo de la ERC, como la dislipidemia, la hipertensión y la hiperglucemia [108]. En resumen, otros factores como la fibra y los fitoquímicos pueden desempeñar un papel en la protección renal en las dietas basadas en alimentos integrales de origen vegetal; sin embargo, estos componentes no pueden ser totalmente responsables de los beneficios renales observados en los estudios que utilizan aislados de proteínas. En las dietas con alto contenido en alimentos vegetales integrales, es más probable que el efecto positivo sobre la función renal se deba a los efectos sinérgicos de las proteínas vegetales y de otros componentes vegetales. Este efecto renoprotector es la base para recomendar la incorporación de proteínas vegetales de alta calidad no sólo en la dieta de las personas con insuficiencia renal [109], sino también de la población en general.
Proteínas vegetales para obtener masa corporal magra y fuerza
Satisfacer las necesidades totales de proteínas diarias es importante para las personas que realizan un entrenamiento de fuerza o de resistencia. Además, el concepto de alcanzar los umbrales de proteínas totales y de contenido de leucina en las comidas de 20-40 y 2-4 g, respectivamente, varias veces al día para promover la síntesis proteica muscular "máxima" (SPM) [60],[110],[111],[112],[113],[114] se ha hecho popular entre las personas activas (jóvenes y mayores). La mayoría de los estudios que examinan los efectos de la dosis de proteínas en las comidas sobre la síntesis de proteínas musculares, especialmente después del entrenamiento de resistencia, se alimentan de proteínas animales de alta calidad, como las proteínas lácteas (por ejemplo, suero de leche y caseína) o de huevo. Tang et al. [115] estudiaron el efecto de la alimentación con hidrolizado de suero de leche, proteína de soja y caseína, emparejados para proporcionar 10 g de aminoácidos indispensables, sobre la MPS mixta en reposo y durante un período de 3 horas después de un entrenamiento de resistencia unilateral de piernas. Después del ejercicio, el hidrolizado de suero promovió una MPS significativamente mayor que la soja o la caseína. Sin embargo, la proteína de soja superó a la caseína en reposo y después del ejercicio. Además, aunque fue significativamente menor, la tasa de síntesis fraccionada (%/h) de MPS después del ejercicio para la proteína de soja seguía siendo aproximadamente el 80% de la del suero. Los autores atribuyeron este hallazgo a las diferencias en las tasas de digestión de las tres proteínas o a su contenido de leucina. Dado que la proteína de soja tiene un menor porcentaje de leucina (~8%) en comparación con la proteína de suero de leche (~12%), es posible que simplemente proporcionar un poco más de proteína de soja para alcanzar el umbral crítico de leucina sea todo lo que se necesita para promover niveles comparables de MPS después del ejercicio entre las dos proteínas.
Los estudios realizados con otras proteínas vegetales tienden a corroborar esta afirmación. En una muestra de mujeres jóvenes que también realizaban un entrenamiento de resistencia unilateral de piernas, el aumento de la ingesta de proteínas hasta el doble de la RDA de proteína de papa elevó la MPS de 24 horas tanto en reposo como asociada al ejercicio por encima del nivel de referencia [28]. Curiosamente, en este estudio, la suplementación con un placebo de carbohidratos isocalóricos también causó incrementos comparables en la MPS tanto en el estado de reposo como en el de post-ejercicio, por lo que los verdaderos beneficios de la proteína de papa no estaban claros. En otro estudio, la ingestión de 35 g de caseína micelar por parte de hombres mayores (que no hacían ejercicio) frente a 35 g de hidrolizado de proteína de trigo provocó mayores aumentos de MPS en el periodo de postexigencia de 4 horas [116]. Sin embargo, al aumentar la dosis de hidrolizado de proteína de trigo a 60 g se produjeron tasas de MPS que superaron las de 35 g de proteína de suero y fueron comparables a las de 35 g de caseína micelar.
Las medidas agudas de MPS que se producen unas horas después de la ingestión de proteínas tienen un valor cuestionable para predecir las ganancias de masa corporal magra a largo plazo con el entrenamiento [117]. El aumento de la masa muscular es un proceso complejo que se ve afectado por una serie de factores fisiológicos, por lo que se necesitan estudios de entrenamiento reales que evalúen la influencia de la suplementación proteica en el aumento de la masa muscular y la fuerza a lo largo del tiempo para evaluar mejor el valor de las proteínas vegetales para la construcción muscular. Algunos estudios de entrenamiento de resistencia (12-36 semanas) en adultos jóvenes han informado de que la leche líquida o la proteína de suero es superior a la leche de soja o a la proteína de soja para la masa muscular y la fuerza [118],[119]. Sin embargo, un reciente meta-análisis de nueve estudios de entrenamiento de resistencia con un total de 266 participantes [120] se llevó a cabo para evaluar los efectos de las dosis emparejadas de proteína de soja frente a las proteínas animales en los resultados de masa muscular y fuerza. De los nueve estudios del meta-análisis, cinco compararon el suero de leche con la soja, mientras que cuatro compararon la soja con otras proteínas (carne de vacuno, leche o proteínas lácteas). Los sujetos incluían tanto adultos jóvenes (18-38 años) como mayores (61-67 años) y la duración del entrenamiento oscilaba entre 6 y 36 semanas (2-5 veces por semana). Las cantidades de proteína añadidas a la dieta oscilaron entre 18 y 85 g/día. No hubo diferencias entre la proteína de soja y las proteínas animales en cuanto a la mejora de la fuerza en el press de banca, la fuerza en sentadilla/prensa de piernas o los resultados de la masa corporal magra.
Los estudios de entrenamiento también han informado de resultados positivos para otras proteínas vegetales distintas de la soja. Joy et al. [121] informaron de que 48 g/día de aislado de proteína de arroz o de suero de leche en los días de entrenamiento durante un programa de entrenamiento de resistencia de ocho semanas en adultos de edad universitaria provocaron mejoras similares en la composición corporal y en la fuerza del press de banca y de piernas. Un estudio en artistas marciales mixtos de élite sometidos a seis semanas de entrenamiento intenso no demostró diferencias entre 75 g/día de aislado de proteína de suero o de arroz en los resultados de la composición corporal [122]. Además, se demostró que la suplementación con proteína de guisante (25 g dos veces al día) durante 12 semanas de entrenamiento de resistencia aumentó el grosor del músculo del bíceps en la misma medida que una cantidad equivalente de proteína de suero [123]. Asimismo, Banaszek et al. [124] suplementaron a los participantes en un programa de entrenamiento funcional de alta intensidad durante ocho semanas con 48 g/día de proteína de suero o de guisante y observaron que ambas proteínas daban lugar a una composición corporal, un grosor muscular, una producción de fuerza, un rendimiento en el entrenamiento y una fuerza similares. Por último, un meta-análisis de los efectos de la ingesta de proteínas en los resultados del entrenamiento de resistencia concluyó que las principales consideraciones para la ingesta de proteínas eran lograr una ingesta de 1,6 g/kg de peso corporal al día, separándola en dosis de 0,25 g/kg [125]. De menor importancia eran factores como el momento de la ingesta, la dosis de proteínas después del ejercicio y la fuente de proteínas. Parte de la explicación de las diferencias de eficacia entre las proteínas vegetales y las animales puede tener que ver con los resultados a corto plazo (p. ej., MPS) en comparación con los resultados a largo plazo (p. ej., aumento de la masa corporal magra real).
La proteína de suero es bastante eficaz para promover aumentos tanto en las medidas a corto plazo de MPS como en las ganancias inducidas por el entrenamiento de resistencia en la masa corporal magra y la fuerza y, en gran parte debido a su alto contenido de leucina, puede conducir a estas mejoras en dosis más bajas (<30 g/día) [119] que las que se podrían lograr con las proteínas vegetales. Sin embargo, la suplementación con dosis mayores de proteínas vegetales (40 g/día o más) puede proporcionar resultados de fitness similares a los conseguidos con la proteína de suero. La mayor disponibilidad de concentrados y aislados de proteínas vegetales facilita ahora la consecución de estas ingestas más elevadas de proteínas vegetales para aquellos que deseen inclinar la balanza de su ingesta de proteínas en mayor medida hacia las fuentes vegetales.
Antinutrientes
Un problema de salud asociado al aumento de la ingesta de proteínas de origen vegetal es la presencia de antinutrientes en los alimentos vegetales. Los antinutrientes son sustancias naturales producidas por las plantas que pueden interferir en la digestión, la absorción o la utilización de los nutrientes de los alimentos y pueden tener también otros efectos adversos [126]. Los efectos adversos de los antinutrientes pueden incluir el intestino permeable y los efectos autoinmunes (p. ej, lectinas y algunas saponinas), la mala digestión de las proteínas (inhibidores de la tripsina y la proteasa), la mala digestión de los hidratos de carbono (inhibidores de la alfa-amilasa), la mala absorción de los minerales (fitatos, taninos y oxalatos), la interferencia con la captación de yodo por parte de la tiroides (goitrógenos), la disfunción intestinal, la inflamación y los efectos sobre el comportamiento (conversión de las gliadinas de los cereales en exorfinas) [126]. A menudo, los efectos adversos de los antinutrientes se han observado en animales alimentados con proteínas vegetales no procesadas y estas observaciones han desencadenado temores en las personas respecto al consumo de algunos alimentos vegetales. Sin embargo, es importante señalar que los antinutrientes no siempre están asociados a efectos adversos y, en algunos casos, sus efectos en el organismo pueden ser positivos. En niveles bajos, los fitatos, las lectinas, los compuestos fenólicos, los inhibidores enzimáticos y las saponinas pueden ayudar a reducir la glucosa en sangre y/o el colesterol y los triglicéridos en plasma [126]. Las saponinas pueden ayudar a la función hepática y reducir la aglutinación de las plaquetas, y algunas saponinas, así como los fitatos, los inhibidores de la proteasa, los lignanos y los fitoestrógenos, pueden reducir el riesgo de cáncer [126]. Además, los taninos pueden tener efectos antimicrobianos [126]. Por ello, algunos de los beneficios para la salud de las dietas basadas en plantas pueden atribuirse a la presencia de bajos niveles de estos "antinutrientes". Por último, existen múltiples vías para reducir en gran medida la concentración de antinutrientes en las proteínas vegetales, como el remojo, la fermentación, la germinación, el calentamiento, la irradiación gamma y las tecnologías genómicas [126]. Las técnicas de procesamiento de alimentos permiten eliminar en gran medida los antinutrientes, como los glucosinolatos, los fitatos, el ácido erúcico y la fibra insoluble de las proteínas de canola o de colza, lo que mejora notablemente su biodisponibilidad [26]. Dado que los concentrados y aislados de proteínas vegetales suelen someterse a un proceso que elimina en su mayor parte los antinutrientes, su digestibilidad suele ser mucho mayor que cuando la proteína permanece en la matriz del alimento entero. Por ejemplo, la digestibilidad proteica del aislado de proteína de soja es del 96% o superior, mientras que la digestibilidad proteica de la harina de soja es sólo del 84% [24],[25].
Proteína de soja e isoflavonas
La proteína de soja ha sido durante algún tiempo el objetivo tanto de las afirmaciones de promoción de la salud como de la preocupación por los posibles efectos adversos para la salud debido a su contenido en isoflavonas. Las isoflavonas son compuestos que tienen elementos de su estructura química similares a los estrógenos y algunos se unen débilmente a los receptores de estrógenos [127]. Se ha planteado la preocupación de que las isoflavonas de la soja puedan tener efectos de alteración endocrina en las hormonas reproductivas, basándose en gran medida en estudios in vitro de cultivos celulares o de roedores con grandes dosis de isoflavonas [128],[129],[130]. El contenido de isoflavonas de varios ingredientes de proteína de soja se ha notificado de la siguiente manera (en base húmeda, expresado como agliconas): harinas de soja desgrasada y entera (120-340 mg/100 g), aislados de proteína de soja (88-164 mg/100 g), proteínas de soja texturizadas comerciales (66-183 mg/100 g) y harinas de hipocótilo de soja (542-851 mg/100 g) [131]. Múltiples investigaciones en los últimos 15 años han demostrado que las preocupaciones sobre los efectos hormonales adversos de las cantidades fisiológicas de alimentos de soja en la dieta son en gran medida infundadas. En 2015, la Autoridad Europea de Seguridad Alimentaria realizó una evaluación exhaustiva de la seguridad de los suplementos de isoflavonas para las mujeres peri y posmenopáusicas. La evaluación demostró que dosis diarias de 35-150 mg de isoflavonas en esta población no provocaron un aumento del riesgo de cáncer de mama, ni efectos sobre el grosor del endometrio o los cambios histopatológicos en el útero a lo largo de 30 meses (algunos cambios histopatológicos no malignos a los 60 meses), ni cambios en el estado de las hormonas tiroideas [132].
Un metaanálisis de 15 estudios controlados con placebo en hombres de distintas edades ha informado de que la ingesta de proteína de soja de hasta 60 g/día no se ha asociado a alteraciones significativas de la testosterona, la globulina fijadora de hormonas sexuales, la testosterona libre o el índice de andrógenos libres [133]. De manera similar, Dillingham et al. [134] observaron que la alimentación de aproximadamente 32 g de proteína/día durante 57 días de proteína de soja de bajo o alto contenido de isoflavonas se asoció con sólo cambios menores en las hormonas reproductivas séricas en hombres jóvenes sanos. En otra comparación de la suplementación con proteína de soja de baja o alta isoflavona, la suplementación con proteína, independientemente del contenido de isoflavona, no influyó en los parámetros de calidad del semen (volumen de semen, concentración de espermatozoides, recuento de espermatozoides, movilidad de los espermatozoides, porcentaje de movilidad de los espermatozoides, recuento total de espermatozoides móviles o morfología de los espermatozoides) en hombres jóvenes sanos [135].
Dado que algunos tipos de cáncer de mama pueden ser sensibles a los estrógenos, se ha cuestionado la seguridad de la soja para las pacientes con cáncer de mama. La cuestión de si la proteína de soja/las isoflavonas de soja afectan al riesgo de cáncer de mama o a su recurrencia también se ha abordado en múltiples investigaciones y revisiones. Messina [127] llegó a la conclusión de que los alimentos a base de soja no aumentan el riesgo de cáncer de mama y no empeoran los resultados del cáncer en las mujeres con cáncer de mama. Un meta-análisis en 2016 y dos más en 2019 informaron de conclusiones similares y sugirieron además que la ingesta de alimentos de soja puede estar asociada con una disminución del riesgo de cáncer de mama y una mejor supervivencia del cáncer de mama [136],[137],[138]. Una revisión sistemática de 13 estudios de cohortes prospectivos para la incidencia de cáncer de mama primario y cinco estudios de cohortes prospectivos que examinan el riesgo de recurrencia y mortalidad (4-7 años de seguimiento tras el primer diagnóstico) [139],[140] afirmó que los alimentos a base de soja no afectan al riesgo de cáncer de mama primario, pero, en pacientes con cáncer de mama, una dieta rica en soja se asocia con una disminución del 25 % en la recurrencia del cáncer y una disminución del 15 % en la mortalidad. El efecto protector de la soja fue significativo tanto en los tipos de cáncer de mama con receptores de estrógeno positivos como negativos, pero la reducción de la recurrencia fue mayor en el tipo de cáncer de mama con receptores de estrógeno negativos (HR = 0,64; IC del 95%: 0,44-0,94) en comparación con el tipo de cáncer de estrógeno positivo (HR = 0,81; IC del 95%: 0,63-1,04). La Sociedad Americana del Cáncer apoya la ingesta de alimentos de soja en las supervivientes de cáncer de mama [141].
Las posibles preocupaciones sobre los efectos de los alimentos de soja en la función tiroidea pueden constituir un obstáculo para el aumento de la ingesta de proteínas de soja entre los consumidores. Estas cuestiones surgieron a raíz de algunos casos de bocio [el bocio es el aumento difuso o nodular del tamaño de la glándula tiroides presente en el momento del nacimiento] en bebés que tomaban leche de fórmula de soja hace 60 años [142],[143] y de investigaciones in vivo [144] e in vitro [145] que sugieren que las isoflavonas inhiben la actividad de la peroxidasa tiroidea, una enzima clave que, junto con el yodo, ayuda a la tiroides a sintetizar las hormonas triyodotironina (T3) y tiroxina (T4).
A pesar de las primeras preocupaciones sobre los posibles efectos nocivos de la soja en la función tiroidea, el peso de las pruebas actuales apunta con más fuerza a la seguridad de la soja. Recientemente, Otun et al.[146] realizaron una revisión sistemática y un metanálisis de 18 estudios sobre los efectos de los alimentos/isoflavonas de soja en la función de la hormona tiroidea en adultos. No hubo efectos generales de la soja o las isoflavonas sobre la función tiroidea, aunque los autores observaron un modesto aumento de la TSH en algunos estudios que no tenía una relevancia clínica clara. Por último, la ausencia de una asociación epidemiológica entre la ingesta de alimentos a base de soja y la función tiroidea en los países en los que la ingesta de soja es elevada es un argumento más a favor de la seguridad de la soja. Aunque no se puede descartar la posibilidad de efectos adversos de la soja sobre la función tiroidea en algunas subpoblaciones (por ejemplo, las que tienen un estado de yodo marginal o hipotiroidismo subclínico), los individuos con una función tiroidea y una ingesta de yodo normales deberían poder consumir alimentos/proteínas de soja con seguridad [147].
Con respecto a los individuos hipotiroideos que toman medicación sustitutiva de la tiroides, existen pruebas limitadas de estudios de casos que indican que los alimentos a base de soja pueden interferir en cierto grado con la absorción de levotiroxina en algunos individuos hipotiroideos [148]. Sin embargo, incluso en esta situación, la ingesta razonable de alimentos a base de soja puede seguir siendo aceptable si la dosis de levotiroxina se aumenta o se programa de forma que no coincida con la ingesta de soja [147], [148].
Proteínas de origen vegetal y propiedades alergénicas
Como se ha mencionado anteriormente, la tendencia a aumentar el consumo de proteínas vegetales se debe a las pruebas disponibles que indican que la fuente de proteínas (o, el "paquete" de proteínas), y no sólo la cantidad de proteínas, influye en nuestra salud. Los profesionales de la salud recomiendan añadir diferentes fuentes de proteínas, como la soja, las alubias, los frutos secos u otras proteínas de origen vegetal, en lugar de la carne roja y las carnes procesadas, para reducir el riesgo de varias enfermedades [149]. A medida que la industria de los alimentos saludables ha ido creciendo, los fabricantes de alimentos se han centrado en la tendencia a incorporar más alimentos de origen vegetal para atraer a los consumidores. Esta es una tendencia no sólo en los adultos, sino también en la población pediátrica. Cada vez más, los padres y cuidadores alimentan a los bebés y niños pequeños con "leche" de origen vegetal como alternativa a la leche de vaca [150],[151],[152],[153],[154], además de ofrecer más opciones vegetarianas, como nuggets y hamburguesas de origen vegetal, en el plan de comidas diarias de sus hijos. Estas opciones dietéticas pueden tener resultados no deseados.
Uno de estos resultados es la alergia. Una alergia alimentaria es un efecto adverso para la salud resultante de una respuesta inmunitaria específica que se produce de forma reproducible al exponerse a un determinado alimento [155]. El efecto sobre la salud, denominado reacción alérgica, se produce porque el sistema inmunitario ataca a proteínas alimentarias que normalmente son inocuas. Los síntomas van de leves y transitorios a graves y potencialmente mortales. Según Food Allergy Research and Education, 32 millones de estadounidenses viven con alergias alimentarias potencialmente mortales. Según una revisión de la literatura, se estima que la alergia alimentaria afecta a más del 1-2% y a menos del 10% de la población [156].
En EE.UU. se han identificado más de 170 alimentos como desencadenantes de alergias alimentarias [155]. Los alimentos más comunes que causan la mayoría de las reacciones alérgicas significativas son el maní, los frutos secos, el pescado, los mariscos, la leche, el huevo, el trigo y la soja [155]. Las alergias alimentarias más comunes en niños y adultos en Estados Unidos son las alergias al maní, la leche, los mariscos y los frutos secos, siendo la leche la más prevalente en los niños y los mariscos en los adultos [157],[158]. Los alérgenos alimentarios más comunes en otros países son: las semillas de sésamo en Canadá, la Unión Europea (UE) y Australia/Nueva Zelanda; la mostaza en la UE y Canadá; el alforfón en Japón y Corea; y los altramuces en la UE [159]. Los anteriores se han convertido en alérgenos alimentarios comunes, ya que se consumen con frecuencia, en cantidades relativamente grandes y en etapas tempranas de la vida. A medida que aumente el consumo de proteínas vegetales, también lo hará el porcentaje de respuestas alergénicas por estas mismas razones.
Tomemos, por ejemplo, los Lupinus. El género Lupinus está estrechamente relacionado con otras legumbres, como el maní, la soja, los garbanzos, los guisantes, las lentejas y las judías [160]. En la UE, la harina de lupino y otros ingredientes proteicos de lupino se introdujeron en los años 90 como sustitutos de la soja y el trigo [161]. Desde su introducción, se observaron reacciones cruzadas alérgicas en algunas personas alérgicas al maní. Esto también se observó en Australia, y ahora el altramuz figura en las listas de alérgenos prioritarios del Subcomité de Nomenclatura de Alérgenos de la Unión Internacional de Sociedades de Inmunología en la UE y en Australia [161].
La historia es muy similar a la de la proteína de soja. La soja es originaria del sudeste asiático y se domesticó por primera vez en China hacia el año 1100 a.C., y no se introdujo en EE.UU. hasta la década de 1760 [162]. El tofu y la salsa de soja fueron algunos de los primeros alimentos de soja para el ser humano. En 1930 se desarrollaron los preparados de soja para lactantes, pero su uso no se generalizó hasta la década de 1950. En 1959 se introdujeron por primera vez los aislados de proteína de soja. Desde la década de 1950, cuando algunos bebés alérgicos a la leche que pasaron a la fórmula de soja desarrollaron posteriormente alergia a la soja, hasta la década de 1960, cuando se hizo posible una mayor ingesta de proteína de soja en múltiples fuentes alimentarias diferentes, la prevalencia de las alergias a la soja aumentó. Aun así, la soja ha demostrado su valor como fuente de calidad de proteínas de origen vegetal. Los estudios realizados en niños han demostrado que la soja favorece el crecimiento y el desarrollo normales [163] y mejora el crecimiento cuando se sustituye por otras legumbres en niños desnutridos [164],[165]. En general, existen numerosas pruebas que demuestran el valor de la soja como parte de una dieta sana y variada [166]. Todas las proteínas alimentarias tienen el potencial de causar reacciones alérgicas, y los niños tienden a ser más sensibles a las proteínas alimentarias que los adultos [167]. Aunque la soja es un alérgeno potencial en los niños, la alergia a la soja en los niños es mucho menos común que las alergias a los lácteos [168], y la alergia a la soja tiene una prevalencia de sólo el 0,4% entre los niños estadounidenses [169],[170] y el 0,32% en los niños canadienses [171]. Esto se compara con las tasas de prevalencia del 2,0-3,0% para la alergia a la leche [170],[172], el 2,0% para el maní [170], el 0,8-2,0% para los huevos [173],[174] y el 1,0% para los frutos secos [170],[175],[176]. Los niños también tienden a superar las alergias a la soja con el tiempo. Un estudio informó de que aproximadamente el 70% de los bebés con alergia a la soja la habían superado a la edad de dos años [177], y las pruebas sugieren que, a la edad de 10 años, sólo 1 de cada 1000 niños sigue teniendo alergia a la soja [175].
El análisis químico de las proteínas vegetales se viene realizando desde hace siglos, y el aislamiento de las proteínas del gluten del trigo se remonta a hace más de 250 años [178]. Más recientemente, se ha puesto cada vez más énfasis en el papel de las proteínas vegetales como alérgenos, sobre todo en Europa y Estados Unidos, y en relación con los alimentos nuevos y transgénicos [178]. Los alérgenos alimentarios de origen vegetal se clasifican en cuatro familias principales: la superfamilia de las prolaminas, la superfamilia de las cupinas, la familia Bet v 1 y las profilinas. Más del 50% de los alérgenos de las proteínas vegetales se clasifican en dos categorías, las superfamilias de las prolaminas y las cupinas [178]. La familia de las prolaminas se caracteriza por la presencia de un patrón conservado de ocho residuos de aminoácidos de cisteína CXnCXnCCXnCXnCXnC. Esto estabiliza la estructura de la proteína, lo que contribuye a la alergenicidad general de las proteínas de esta clase (altamente resistente al calentamiento, la proteólisis y la digestión). Los principales alérgenos son las prolaminas de los cereales, las albúminas 2S, las proteínas de transferencia de lípidos no específicas y las familias de proteínas α-amilasa e inhibidoras de tripsina [179],[180],[181],[182],[183].
La familia de las prolaminas son proteínas de semillas que incluyen, entre otras, el trigo, la cebada, el centeno, la soja, el arroz, el maíz y el girasol. Por consiguiente, la superfamilia de las prolaminas constituye actualmente el grupo más grande y más ampliamente distribuido de alérgenos alimentarios vegetales [178]. Se puede visitar la base de datos del Programa de Recursos para la Investigación de Alergias Alimentarias (FARRP) (http://www.allergenonline.com/) para conocer más tipos diferentes de alérgenos. La base de datos FARRP contiene una lista exhaustiva de 2171 entradas de secuencias de proteínas (aminoácidos) que se clasifican en 873 grupos taxonómicos de proteínas de alérgenos únicos probados o putativos (alimentos, vías respiratorias, veneno/saliva y contacto) de 423 especies [184].
Todas las fuentes de proteínas pueden tener un efecto alergénico. A medida que aparecen en el mercado nuevas fuentes de proteínas de origen vegetal, es inevitable que provoquen una respuesta alergénica en alguien. Un ejemplo de ello es la proteína de arveja. Las arvejas forman parte de la familia de las leguminosas, que también incluye el maní, las alubias, las lentejas y la soja. Debido a que otras proteínas vegetales, como la soja y el trigo, tienen respuestas alergénicas documentadas, la proteína de arveja se ha considerado una alternativa potencialmente menos alergénica. La disponibilidad de la proteína de arveja, sus características físicas y de procesamiento, su valor nutricional y su bajo coste han incrementado su uso como alternativa novedosa y eficaz para sustituir a las proteínas de soja o de origen animal en los alimentos funcionales [185]. Se puede encontrar en polvos proteicos, fórmulas médicas y una variedad de sustancias alimenticias como la leche, el yogur, el queso y los productos horneados. Aunque no es habitual, se han documentado casos de personas con una alergia demostrada al maní que han tenido una reacción a la proteína de arveja [186],[187]. Lo interesante es que las arvejas amarillas cocidas sin más (por ejemplo, la entrada de arveja, partidas, con semillas maduras, cocidas, hervidas y sin sal) tienen una media de aproximadamente el 8% de proteínas en peso [37]. En comparación, los productos actuales incluyen aislados de proteína de arveja(70-95% de proteína), concentrados (60-70% de proteína) e hidrolizados (90-95% de proteína) [186]. Los productos mencionados proporcionan cargas proteicas mucho más altas que las de una persona que come una ración de arvejas cocidas. No es de extrañar, por tanto, que alguien que no sea alérgico a una ración de arvejas enteras pueda experimentar una respuesta alérgica a las dosis mucho mayores de proteína de arveja que se encuentran en los productos que contienen concentrados y aislados de arveja. Aunque algunos creen que las proteínas de arveja y de soja tienen una prevalencia alergénica similar [188], la alergenicidad de las proteínas de arveja no se ha estudiado ampliamente. Aunque en EE.UU. o Canadá no es obligatorio identificar las proteínas de arveja como un posible alérgeno en las etiquetas de los alimentos, algunos han tomado nota de la arveja como "alérgeno oculto" [189].
Aunque todas las proteínas alimentarias son proteínas extrañas para el sistema inmunitario humano, sólo unas pocas proteínas de origen vegetal y animal provocan una respuesta inmunitaria mediada por IgE, normalmente en un número reducido de personas [159]. Las categorías de proteínas vegetales incluyen las legumbres, los frutos secos y las semillas, los cereales integrales y otros (principalmente frutas y verduras). En el momento de esta investigación científica, no hay datos suficientes sobre todas las proteínas vegetales, ya que algunas son nuevas y las respuestas alergénicas están empezando a surgir. Esto no significa que no deban explorarse nuevas fuentes de proteínas, sino que el etiquetado debe ser claro para que quienes desarrollen una alergia sepan qué contienen.
Conclusiones
Los productos elaborados con proteínas de origen vegetal y las dietas integrales basadas en plantas son cada vez más populares. La proteína vegetal se ha asociado a beneficios relacionados con la salud y la condición física. La tendencia a aumentar la ingesta de proteínas vegetales continúa aumentando a medida que los consumidores amplían sus conocimientos sobre los beneficios nutricionales de las proteínas vegetales. Las proteínas vegetales también pueden ser más valiosas si se revisan al alza las actuales recomendaciones de proteínas para la salud pública. Sin embargo, las proteínas vegetales difieren en cuanto a su calidad nutricional y quienes opten por dar mayor importancia a las proteínas vegetales que a las animales deben ser conscientes de estas diferencias a la hora de planificar una dieta adecuada.
Hacer clic en Referencias para desplegarlas.
Henchion M, Hayes M, Mullen AM, Fenelon M, Tiwari B. Future Protein Supply and Demand: Strategies and Factors Influencing a Sustainable Equilibrium. Foods. 2017 Jul 20;6(7):53. doi: 10.3390/foods6070053. PMID: 28726744; PMCID: PMC5532560.
Houston DK, Nicklas BJ, Ding J, Harris TB, Tylavsky FA, Newman AB, Lee JS, Sahyoun NR, Visser M, Kritchevsky SB; Health ABC Study. Dietary protein intake is associated with lean mass change in older, community-dwelling adults: the Health, Aging, and Body Composition (Health ABC) Study. Am J Clin Nutr. 2008 Jan;87(1):150-5. doi: 10.1093/ajcn/87.1.150. PMID: 18175749.
Hudson JL, Wang Y, Bergia Iii RE, Campbell WW. Protein Intake Greater than the RDA Differentially Influences Whole-Body Lean Mass Responses to Purposeful Catabolic and Anabolic Stressors: A Systematic Review and Meta-analysis. Adv Nutr. 2020 May 1;11(3):548-558. doi: 10.1093/advances/nmz106. PMID: 31794597; PMCID: PMC7231581.
Mitchell CJ, Milan AM, Mitchell SM, Zeng N, Ramzan F, Sharma P, Knowles SO, Roy NC, Sjödin A, Wagner KH, Cameron-Smith D. The effects of dietary protein intake on appendicular lean mass and muscle function in elderly men: a 10-wk randomized controlled trial. Am J Clin Nutr. 2017 Dec;106(6):1375-1383. doi: 10.3945/ajcn.117.160325. Epub 2017 Nov 1. PMID: 29092886.
Oikawa SY, McGlory C, D'Souza LK, Morgan AK, Saddler NI, Baker SK, Parise G, Phillips SM. A randomized controlled trial of the impact of protein supplementation on leg lean mass and integrated muscle protein synthesis during inactivity and energy restriction in older persons. Am J Clin Nutr. 2018 Nov 1;108(5):1060-1068. doi: 10.1093/ajcn/nqy193. PMID: 30289425.
Park Y, Choi JE, Hwang HS. Protein supplementation improves muscle mass and physical performance in undernourished prefrail and frail elderly subjects: a randomized, double-blind, placebo-controlled trial. Am J Clin Nutr. 2018 Nov 1;108(5):1026-1033. doi: 10.1093/ajcn/nqy214. PMID: 30475969.
Kerstetter JE, Looker AC, Insogna KL. Low dietary protein and low bone density. Calcif Tissue Int. 2000 Apr;66(4):313. doi: 10.1007/s002230010062. PMID: 10742451.
Hannan MT, Tucker KL, Dawson-Hughes B, Cupples LA, Felson DT, Kiel DP. Effect of dietary protein on bone loss in elderly men and women: the Framingham Osteoporosis Study. J Bone Miner Res. 2000 Dec;15(12):2504-12. doi: 10.1359/jbmr.2000.15.12.2504. PMID: 11127216.
Rapuri PB, Gallagher JC, Haynatzka V. Protein intake: effects on bone mineral density and the rate of bone loss in elderly women. Am J Clin Nutr. 2003 Jun;77(6):1517-25. doi: 10.1093/ajcn/77.6.1517. PMID: 12791633.
Pimentel D, Pimentel M. Sustainability of meat-based and plant-based diets and the environment. Am J Clin Nutr. 2003 Sep;78(3 Suppl):660S-663S. doi: 10.1093/ajcn/78.3.660S. PMID: 12936963.
Trumbo P, Schlicker S, Yates AA, Poos M; Food and Nutrition Board of the Institute of Medicine, The National Academies. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein and amino acids. J Am Diet Assoc. 2002 Nov;102(11):1621-30. doi: 10.1016/s0002-8223(02)90346-9. Erratum in: J Am Diet Assoc. 2003 May;103(5):563. PMID: 12449285.
Boye J, Wijesinha-Bettoni R, Burlingame B. Protein quality evaluation twenty years after the introduction of the protein digestibility corrected amino acid score method. Br J Nutr. 2012 Aug;108 Suppl 2:S183-211. doi: 10.1017/S0007114512002309. PMID: 23107529.
Food and Agricultural Organization of the United Nations . FAO Food and Nutrition Paper 51: Protein Quality Evaluation: Report of a Joint FAO/WHO Expert Consultation. FAO; Rome, Italy: 1991. pp. 1–66.
Darragh AJ, Hodgkinson SM. Quantifying the digestibility of dietary protein. J Nutr. 2000 Jul;130(7):1850S-6S. doi: 10.1093/jn/130.7.1850S. PMID: 10867062.
Schaafsma G. The protein digestibility-corrected amino acid score. J Nutr. 2000 Jul;130(7):1865S-7S. doi: 10.1093/jn/130.7.1865S. PMID: 10867064.
Food and Agricultural Organization of the United Nations . FAO Food and Nutrition Paper 92: Dietary Protein Quality Evaluation in Human Nutrition: Report of an FAO Expert Consultation. FAO; Rome, Italy: 2013. pp. 1–66
Hoffman JR, Falvo MJ. Protein - Which is Best? J Sports Sci Med. 2004 Sep 1;3(3):118-30. PMID: 24482589; PMCID: PMC3905294.
U.S. Dairy Export Council Reference Manual for U.S. Milk Powders 2019 Revised Edition.
Young VR, Pellett PL. Plant proteins in relation to human protein and amino acid nutrition. Am J Clin Nutr. 1994 May;59(5 Suppl):1203S-1212S. doi: 10.1093/ajcn/59.5.1203S. PMID: 8172124.
Mathai JK, Liu Y, Stein HH. Values for digestible indispensable amino acid scores (DIAAS) for some dairy and plant proteins may better describe protein quality than values calculated using the concept for protein digestibility-corrected amino acid scores (PDCAAS). Br J Nutr. 2017 Feb;117(4):490-499. doi: 10.1017/S0007114517000125. PMID: 28382889.
Rutherfurd SM, Fanning AC, Miller BJ, Moughan PJ. Protein digestibility-corrected amino acid scores and digestible indispensable amino acid scores differentially describe protein quality in growing male rats. J Nutr. 2015 Feb;145(2):372-9. doi: 10.3945/jn.114.195438. Epub 2014 Nov 26. PMID: 25644361.
Moughan P.J., Gilani S., Rutherfurd S.M., Tome D. Report of a Sub-comittee of the 2011 FAO Consulation on "Protein Quality Evaluation in Human Nutrition" on: The Assessment of Amino Acid Digestibility in Foods for Humans and Including a Collation of Published Ileal Amino acid Digestibility Data for Human Foods. FAO; Rome, Italy: 2013.
Etzel MR. Manufacture and use of dairy protein fractions. J Nutr. 2004 Apr;134(4):996S-1002S. doi: 10.1093/jn/134.4.996S. PMID: 15051860.
US Food and Drug Administration Appendix B. True protein digestibility value of common foods. Fed. Regist. 1993;58:2193–2195.
Hughes GJ, Ryan DJ, Mukherjea R, Schasteen CS. Protein digestibility-corrected amino acid scores (PDCAAS) for soy protein isolates and concentrate: criteria for evaluation. J Agric Food Chem. 2011 Dec 14;59(23):12707-12. doi: 10.1021/jf203220v. Epub 2011 Nov 16. PMID: 22017752.
Fleddermann M, Fechner A, Rößler A, Bähr M, Pastor A, Liebert F, Jahreis G. Nutritional evaluation of rapeseed protein compared to soy protein for quality, plasma amino acids, and nitrogen balance--a randomized cross-over intervention study in humans. Clin Nutr. 2013 Aug;32(4):519-26. doi: 10.1016/j.clnu.2012.11.005. Epub 2012 Nov 14. PMID: 23260747.
Anderson D. DSM CanolaPRO.
Oikawa SY, Bahniwal R, Holloway TM, Lim C, McLeod JC, McGlory C, Baker SK, Phillips SM. Potato Protein Isolate Stimulates Muscle Protein Synthesis at Rest and with Resistance Exercise in Young Women. Nutrients. 2020 Apr 27;12(5):1235. doi: 10.3390/nu12051235. PMID: 32349353; PMCID: PMC7281992.
He T, Spelbrink RE, Witteman BJ, Giuseppin ML. Digestion kinetics of potato protein isolates in vitro and in vivo. Int J Food Sci Nutr. 2013 Nov;64(7):787-93. doi: 10.3109/09637486.2013.793300. Epub 2013 May 28. PMID: 23713493.
HUGHES BP. The amino-acid composition of potato protein and of cooked potato. Br J Nutr. 1958;12(2):188-95. doi: 10.1079/bjn19580026. PMID: 13536266.
Kowalczewski PŁ, Olejnik A, Białas W, Rybicka I, Zielińska-Dawidziak M, Siger A, Kubiak P, Lewandowicz G. The Nutritional Value and Biological Activity of Concentrated Protein Fraction of Potato Juice. Nutrients. 2019 Jul 4;11(7):1523. doi: 10.3390/nu11071523. PMID: 31277482; PMCID: PMC6683274.
KALDY, M.S. and MARKAKIS, P. (1972), AMINO ACID COMPOSITION OF SELECTED POTATO VARIETIES. Journal of Food Science, 37: 375-377
Yang H., Guerin-Deremaux L., Zhou L., Fratus A., Wils D., Zhang C., Zhang K., Miller L.E. Evaluation of nutritional quality of a novel pea protein. Food Anal. 2012;23:8–10
Nowak V, Du J, Charrondière UR. Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.). Food Chem. 2016 Feb 15;193:47-54. doi: 10.1016/j.foodchem.2015.02.111. Epub 2015 Feb 28. PMID: 26433286.
R. Repo-Carrasco, C. Espinoza & S. -E. Jacobsen (2003) Nutritional Value and Use of the Andean Crops Quinoa (Chenopodium quinoa) and Kañiwa (Chenopodium pallidicaule), Food Reviews International, 19:1-2, 179-189
Mota C, Santos M, Mauro R, Samman N, Matos AS, Torres D, Castanheira I. Protein content and amino acids profile of pseudocereals. Food Chem. 2016 Feb 15;193:55-61. doi: 10.1016/j.foodchem.2014.11.043. Epub 2014 Nov 15. PMID: 26433287.
US Department of Agriculture Agricultural Research Service Food Data Central.
Schlick G., Bubenheim D.L. NASA Technical Paper 3422. NASA Ames Research Center; Moffet Field, CA, USA: 1993. Quinoa: An emerging “new” crop with potential for CELSS; pp. 1–6
Ruales J, Nair BM. Nutritional quality of the protein in quinoa (Chenopodium quinoa, Willd) seeds. Plant Foods Hum Nutr. 1992 Jan;42(1):1-11. doi: 10.1007/BF02196067. PMID: 1546052.
Ranhotra G.S., Gelroth J.A., Glaser B.K., Lorenz K.J., Johnson D.L. Composition and protein nutritional quality of quinoa. Cereal Chem. 1993;70:303–305.
El-Adawy TA. Nutritional composition and antinutritional factors of chickpeas (Cicer arietinum L.) undergoing different cooking methods and germination. Plant Foods Hum Nutr. 2002 Winter;57(1):83-97. doi: 10.1023/a:1013189620528. PMID: 11855623.
Pulse Canada Protein Quality of Cooked Pulses.
AdvantaFava AdvantaFava Resolve 90 Technical Specification Version 1.1.
Lisiewska Z., Kmiecik W., Słupski J. Content of amino acids in raw and frozen broad beans (Vicia faba var. major) seeds at milk maturity stage, depending on the processing method. Food Chem. 2007;105:1468–1473.
Kaldy M.S., Kasting R. Amino acid composition and protein quality of eight faba bean cultivars. Can. J. Plan. Sci. 1974;54:869–871. doi: 10.4141/cjps74-155.
Vogelsang-O'Dwyer M, Petersen IL, Joehnke MS, Sørensen JC, Bez J, Detzel A, Busch M, Krueger M, O'Mahony JA, Arendt EK, Zannini E. Comparison of Faba Bean Protein Ingredients Produced Using Dry Fractionation and Isoelectric Precipitation: Techno-Functional, Nutritional and Environmental Performance. Foods. 2020 Mar 11;9(3):322. doi: 10.3390/foods9030322. PMID: 32168773; PMCID: PMC7143175.
Sarwar G, Peace RW. Comparisons between true digestibility of total nitrogen and limiting amino acids in vegetable proteins fed to rats. J Nutr. 1986 Jul;116(7):1172-84. doi: 10.1093/jn/116.7.1172. PMID: 3746456.
Fitzpatrick K., Adolphe J. Barley-a Healthy Protein Source.
Bodwell CE, Satterlee LD, Hackler LR. Protein digestibility of the same protein preparations by human and rat assays and by in vitro enzymic digestion methods. Am J Clin Nutr. 1980 Mar;33(3):677-86. doi: 10.1093/ajcn/33.3.677. PMID: 6986763.
Amagliani L., O’Regan J., Kelly A.L., O’Mahony J.A. Composition and protein profile analysis of rice protein ingredients. J. Food Compos. Anal. 2017;59:18–26. doi: 10.1016/j.jfca.2016.12.026.
Han SW, Chee KM, Cho SJ. Nutritional quality of rice bran protein in comparison to animal and vegetable protein. Food Chem. 2015 Apr 1;172:766-9. doi: 10.1016/j.foodchem.2014.09.127. Epub 2014 Sep 28. PMID: 25442618.
Kalman DS. Amino Acid Composition of an Organic Brown Rice Protein Concentrate and Isolate Compared to Soy and Whey Concentrates and Isolates. Foods. 2014 Jun 30;3(3):394-402. doi: 10.3390/foods3030394. PMID: 28234326; PMCID: PMC5302255.
Tate and Lyle Oat Protein: Health Benefits and Product Applications: Innovating to Meet Nutrition, Health, and Wellness Needs Every Day
Singh B, Singh U. Peanut as a source of protein for human foods. Plant Foods Hum Nutr. 1991 Apr;41(2):165-77. doi: 10.1007/BF02194085. PMID: 1852728.
Shewry PR, Hey SJ. The contribution of wheat to human diet and health. Food Energy Secur. 2015 Oct;4(3):178-202. doi: 10.1002/fes3.64. Epub 2015 Aug 14. PMID: 27610232; PMCID: PMC4998136.
al-Gaby AM. Amino acid composition and biological effects of supplementing broad bean and corn proteins with Nigella sativa (black cumin) cake protein. Nahrung. 1998 Oct;42(5):290-4. doi: 10.1002/(sici)1521-3803(199810)42:05<290::aid-food290>3.0.co;2-y. PMID: 9882224.
Caire-Juvera G, Vázquez-Ortiz FA, Grijalva-Haro MI. Amino acid composition, score and in vitro protein digestibility of foods commonly consumed in northwest Mexico. Nutr Hosp. 2013 Mar-Apr;28(2):365-71. doi: 10.3305/nh.2013.28.2.6219. PMID: 23822687.
Health Canada Elements within the Nutrition Facts Table: Protein.
Kamei Y, Hatazawa Y, Uchitomi R, Yoshimura R, Miura S. Regulation of Skeletal Muscle Function by Amino Acids. Nutrients. 2020 Jan 19;12(1):261. doi: 10.3390/nu12010261. PMID: 31963899; PMCID: PMC7019684.
Breen L, Phillips SM. Skeletal muscle protein metabolism in the elderly: Interventions to counteract the 'anabolic resistance' of ageing. Nutr Metab (Lond). 2011 Oct 5;8:68. doi: 10.1186/1743-7075-8-68. PMID: 21975196; PMCID: PMC3201893.
Wu G. Amino acids: metabolism, functions, and nutrition. Amino Acids. 2009 May;37(1):1-17. doi: 10.1007/s00726-009-0269-0. Epub 2009 Mar 20. PMID: 19301095.
Wu G, Morris SM Jr. Arginine metabolism: nitric oxide and beyond. Biochem J. 1998 Nov 15;336 ( Pt 1)(Pt 1):1-17. doi: 10.1042/bj3360001. PMID: 9806879; PMCID: PMC1219836.
Ramezani Ahmadi A, Rayyani E, Bahreini M, Mansoori A. The effect of glutamine supplementation on athletic performance, body composition, and immune function: A systematic review and a meta-analysis of clinical trials. Clin Nutr. 2019 Jun;38(3):1076-1091. doi: 10.1016/j.clnu.2018.05.001. Epub 2018 May 9. PMID: 29784526.
Li P, Wu G. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino Acids. 2018 Jan;50(1):29-38. doi: 10.1007/s00726-017-2490-6. Epub 2017 Sep 20. PMID: 28929384.
Meléndez-Hevia E, De Paz-Lugo P, Cornish-Bowden A, Cárdenas ML. A weak link in metabolism: the metabolic capacity for glycine biosynthesis does not satisfy the need for collagen synthesis. J Biosci. 2009 Dec;34(6):853-72. doi: 10.1007/s12038-009-0100-9. PMID: 20093739.
Razak MA, Begum PS, Viswanath B, Rajagopal S. Multifarious Beneficial Effect of Nonessential Amino Acid, Glycine: A Review. Oxid Med Cell Longev. 2017;2017:1716701. doi: 10.1155/2017/1716701. Epub 2017 Mar 1. PMID: 28337245; PMCID: PMC5350494.
Wang W, Wu Z, Dai Z, Yang Y, Wang J, Wu G. Glycine metabolism in animals and humans: implications for nutrition and health. Amino Acids. 2013 Sep;45(3):463-77. doi: 10.1007/s00726-013-1493-1. Epub 2013 Apr 25. PMID: 23615880.
Heine WE, Klein PD, Reeds PJ. The importance of alpha-lactalbumin in infant nutrition. J Nutr. 1991 Mar;121(3):277-83. doi: 10.1093/jn/121.3.277. PMID: 2002399.
Paul GL. The rationale for consuming protein blends in sports nutrition. J Am Coll Nutr. 2009 Aug;28 Suppl:464S-472S. doi: 10.1080/07315724.2009.10718113. PMID: 20234034.
Swaisgood H.E. Protein and amino acid composition of bovine milk. In: Jensen R.G., editor. Handbook of Milk Composition. Elsevier; Amsterdam, The Netherlands: 1995. pp. 464–468
Rutherfurd SM, Moughan PJ. The digestible amino acid composition of several milk proteins: application of a new bioassay. J Dairy Sci. 1998 Apr;81(4):909-17. doi: 10.3168/jds.S0022-0302(98)75650-4. PMID: 9594381.
Li SS, Blanco Mejia S, Lytvyn L, Stewart SE, Viguiliouk E, Ha V, de Souza RJ, Leiter LA, Kendall CWC, Jenkins DJA, Sievenpiper JL. Effect of Plant Protein on Blood Lipids: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Am Heart Assoc. 2017 Dec 20;6(12):e006659. doi: 10.1161/JAHA.117.006659. PMID: 29263032; PMCID: PMC5779002.
Zhao H, Song A, Zheng C, Wang M, Song G. Effects of plant protein and animal protein on lipid profile, body weight and body mass index on patients with hypercholesterolemia: a systematic review and meta-analysis. Acta Diabetol. 2020 Oct;57(10):1169-1180. doi: 10.1007/s00592-020-01534-4. Epub 2020 Apr 20. PMID: 32314018.
Lin Y, Mouratidou T, Vereecken C, Kersting M, Bolca S, de Moraes AC, Cuenca-García M, Moreno LA, González-Gross M, Valtueña J, Labayen I, Grammatikaki E, Hallstrom L, Leclercq C, Ferrari M, Gottrand F, Beghin L, Manios Y, Ottevaere C, Van Oyen H, Molnar D, Kafatos A, Widhalm K, Gómez-Martinez S, Prieto LE, De Henauw S, Huybrechts I; HELENA study group. Dietary animal and plant protein intakes and their associations with obesity and cardio-metabolic indicators in European adolescents: the HELENA cross-sectional study. Nutr J. 2015 Jan 21;14:10. doi: 10.1186/1475-2891-14-10. PMID: 25609179; PMCID: PMC4334414.
Campbell WW. Animal-based and plant-based protein-rich foods and cardiovascular health: a complex conundrum. Am J Clin Nutr. 2019 Jul 1;110(1):8-9. doi: 10.1093/ajcn/nqz074. PMID: 31161222; PMCID: PMC6599735.
Richter CK, Skulas-Ray AC, Champagne CM, Kris-Etherton PM. Plant protein and animal proteins: do they differentially affect cardiovascular disease risk? Adv Nutr. 2015 Nov 13;6(6):712-28. doi: 10.3945/an.115.009654. PMID: 26567196; PMCID: PMC4642426.
Bergeron N, Chiu S, Williams PT, M King S, Krauss RM. Effects of red meat, white meat, and nonmeat protein sources on atherogenic lipoprotein measures in the context of low compared with high saturated fat intake: a randomized controlled trial. Am J Clin Nutr. 2019 Jul 1;110(1):24-33. doi: 10.1093/ajcn/nqz035. Erratum in: Am J Clin Nutr. 2019 Sep 1;110(3):783. PMID: 31161217; PMCID: PMC6599736.
Tonstad S, Stewart K, Oda K, Batech M, Herring RP, Fraser GE. Vegetarian diets and incidence of diabetes in the Adventist Health Study-2. Nutr Metab Cardiovasc Dis. 2013 Apr;23(4):292-9. doi: 10.1016/j.numecd.2011.07.004. Epub 2011 Oct 7. PMID: 21983060; PMCID: PMC3638849.
Malik VS, Li Y, Tobias DK, Pan A, Hu FB. Dietary Protein Intake and Risk of Type 2 Diabetes in US Men and Women. Am J Epidemiol. 2016 Apr 15;183(8):715-28. doi: 10.1093/aje/kwv268. Epub 2016 Mar 28. PMID: 27022032; PMCID: PMC4832052.
Smith CE, Mollard RC, Luhovyy BL, Anderson GH. The effect of yellow pea protein and fibre on short-term food intake, subjective appetite and glycaemic response in healthy young men. Br J Nutr. 2012 Aug;108 Suppl 1:S74-80. doi: 10.1017/S0007114512000700. PMID: 22916818.
König D, Muser K, Berg A, Deibert P. Fuel selection and appetite-regulating hormones after intake of a soy protein-based meal replacement. Nutrition. 2012 Jan;28(1):35-9. doi: 10.1016/j.nut.2011.02.008. Epub 2011 Jul 20. PMID: 21778035.
Viguiliouk E, Stewart SE, Jayalath VH, Ng AP, Mirrahimi A, de Souza RJ, Hanley AJ, Bazinet RP, Blanco Mejia S, Leiter LA, Josse RG, Kendall CW, Jenkins DJ, Sievenpiper JL. Effect of Replacing Animal Protein with Plant Protein on Glycemic Control in Diabetes: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2015 Dec 1;7(12):9804-24. doi: 10.3390/nu7125509. PMID: 26633472; PMCID: PMC4690061.
Markova M, Koelman L, Hornemann S, Pivovarova O, Sucher S, Machann J, Rudovich N, Thomann R, Schneeweiss R, Rohn S, Pfeiffer AFH, Aleksandrova K. Effects of plant and animal high protein diets on immune-inflammatory biomarkers: A 6-week intervention trial. Clin Nutr. 2020 Mar;39(3):862-869. doi: 10.1016/j.clnu.2019.03.019. Epub 2019 Mar 27. PMID: 30967307.
Markova M, Pivovarova O, Hornemann S, Sucher S, Frahnow T, Wegner K, Machann J, Petzke KJ, Hierholzer J, Lichtinghagen R, Herder C, Carstensen-Kirberg M, Roden M, Rudovich N, Klaus S, Thomann R, Schneeweiss R, Rohn S, Pfeiffer AF. Isocaloric Diets High in Animal or Plant Protein Reduce Liver Fat and Inflammation in Individuals With Type 2 Diabetes. Gastroenterology. 2017 Feb;152(3):571-585.e8. doi: 10.1053/j.gastro.2016.10.007. Epub 2016 Oct 17. PMID: 27765690.
Pivovarova-Ramich O, Markova M, Weber D, Sucher S, Hornemann S, Rudovich N, Raila J, Sunaga-Franze D, Sauer S, Rohn S, Pfeiffer AFH, Grune T. Effects of diets high in animal or plant protein on oxidative stress in individuals with type 2 diabetes: A randomized clinical trial. Redox Biol. 2020 Jan;29:101397. doi: 10.1016/j.redox.2019.101397. Epub 2019 Nov 28. PMID: 31926623; PMCID: PMC6909130.
Hassanzadeh-Rostami Z, Hemmatdar Z, Pishdad GR, Faghih S. Moderate Consumption of Red Meat, Compared to Soy or Non-Soy Legume, Has No Adverse Effect on Cardio-Metabolic Factors in Patients with Type 2 Diabetes. Exp Clin Endocrinol Diabetes. 2021 Jun;129(6):429-437. doi: 10.1055/a-0929-6287. Epub 2019 Jun 17. PMID: 31207663.
Andersen V, Halekoh U, Tjønneland A, Vogel U, Kopp TI. Intake of Red and Processed Meat, Use of Non-Steroid Anti-Inflammatory Drugs, Genetic Variants and Risk of Colorectal Cancer: A Prospective Study of the Danish "Diet, Cancer and Health" Cohort. Int J Mol Sci. 2019 Mar 5;20(5):1121. doi: 10.3390/ijms20051121. PMID: 30841568; PMCID: PMC6429260.
Møller G, Andersen JR, Jalo E, Ritz C, Brand-Miller J, Larsen TM, Silvestre MP, Fogelholm M, Poppitt SD, Raben A, Dragsted LO. The association of dietary animal and plant protein with putative risk markers of colorectal cancer in overweight pre-diabetic individuals during a weight-reducing programme: a PREVIEW sub-study. Eur J Nutr. 2020 Jun;59(4):1517-1527. doi: 10.1007/s00394-019-02008-2. Epub 2019 May 28. PMID: 31139889.
Chatterjee C, Gleddie S, Xiao CW. Soybean Bioactive Peptides and Their Functional Properties. Nutrients. 2018 Sep 1;10(9):1211. doi: 10.3390/nu10091211. PMID: 30200502; PMCID: PMC6164536.
Lonnie M, Laurie I, Myers M, Horgan G, Russell WR, Johnstone AM. Exploring Health-Promoting Attributes of Plant Proteins as a Functional Ingredient for the Food Sector: A Systematic Review of Human Interventional Studies. Nutrients. 2020 Jul 30;12(8):2291. doi: 10.3390/nu12082291. PMID: 32751677; PMCID: PMC7468935.
Huang J, Liao LM, Weinstein SJ, Sinha R, Graubard BI, Albanes D. Association Between Plant and Animal Protein Intake and Overall and Cause-Specific Mortality. JAMA Intern Med. 2020 Sep 1;180(9):1173-1184. doi: 10.1001/jamainternmed.2020.2790. PMID: 32658243; PMCID: PMC7358979.
Naghshi S, Sadeghi O, Willett WC, Esmaillzadeh A. Dietary intake of total, animal, and plant proteins and risk of all cause, cardiovascular, and cancer mortality: systematic review and dose-response meta-analysis of prospective cohort studies. BMJ. 2020 Jul 22;370:m2412. doi: 10.1136/bmj.m2412. PMID: 32699048; PMCID: PMC7374797.
Grotto D, Zied E. The Standard American Diet and its relationship to the health status of Americans. Nutr Clin Pract. 2010 Dec;25(6):603-12. doi: 10.1177/0884533610386234. PMID: 21139124.
Smyth A, Griffin M, Yusuf S, Mann JF, Reddan D, Canavan M, Newell J, O'Donnell M. Diet and Major Renal Outcomes: A Prospective Cohort Study. The NIH-AARP Diet and Health Study. J Ren Nutr. 2016 Sep;26(5):288-98. doi: 10.1053/j.jrn.2016.01.016. Epub 2016 Mar 12. PMID: 26975776.
Bernier-Jean A, Prince RL, Lewis JR, Craig JC, Hodgson JM, Lim WH, Teixeira-Pinto A, Wong G. Dietary plant and animal protein intake and decline in estimated glomerular filtration rate among elderly women: a 10-year longitudinal cohort study. Nephrol Dial Transplant. 2021 Aug 27;36(9):1640-1647. doi: 10.1093/ndt/gfaa081. PMID: 32457981.
Viberti G, Bognetti E, Wiseman MJ, Dodds R, Gross JL, Keen H. Effect of protein-restricted diet on renal response to a meat meal in humans. Am J Physiol. 1987 Sep;253(3 Pt 2):F388-93. doi: 10.1152/ajprenal.1987.253.3.F388. PMID: 3631277.
Bosch JP, Saccaggi A, Lauer A, Ronco C, Belledonne M, Glabman S. Renal functional reserve in humans. Effect of protein intake on glomerular filtration rate. Am J Med. 1983 Dec;75(6):943-50. doi: 10.1016/0002-9343(83)90873-2. PMID: 6650549.
Stephenson TJ, Setchell KD, Kendall CW, Jenkins DJ, Anderson JW, Fanti P. Effect of soy protein-rich diet on renal function in young adults with insulin-dependent diabetes mellitus. Clin Nephrol. 2005 Jul;64(1):1-11. doi: 10.5414/cnp64001. PMID: 16047639.
Adair KE, Bowden RG. Ameliorating Chronic Kidney Disease Using a Whole Food Plant-Based Diet. Nutrients. 2020 Apr 6;12(4):1007. doi: 10.3390/nu12041007. PMID: 32268544; PMCID: PMC7230354.
Rebholz CM, Coresh J, Grams ME, Steffen LM, Anderson CA, Appel LJ, Crews DC. Dietary Acid Load and Incident Chronic Kidney Disease: Results from the ARIC Study. Am J Nephrol. 2015;42(6):427-35. doi: 10.1159/000443746. Epub 2016 Jan 21. PMID: 26789417; PMCID: PMC4733508.
Goraya N, Simoni J, Jo CH, Wesson DE. A comparison of treating metabolic acidosis in CKD stage 4 hypertensive kidney disease with fruits and vegetables or sodium bicarbonate. Clin J Am Soc Nephrol. 2013 Mar;8(3):371-81. doi: 10.2215/CJN.02430312. Epub 2013 Feb 7. PMID: 23393104; PMCID: PMC3586961.
Goraya N, Simoni J, Jo CH, Wesson DE. Treatment of metabolic acidosis in patients with stage 3 chronic kidney disease with fruits and vegetables or oral bicarbonate reduces urine angiotensinogen and preserves glomerular filtration rate. Kidney Int. 2014 Nov;86(5):1031-8. doi: 10.1038/ki.2014.83. Epub 2014 Apr 2. PMID: 24694986.
Moe SM, Zidehsarai MP, Chambers MA, Jackman LA, Radcliffe JS, Trevino LL, Donahue SE, Asplin JR. Vegetarian compared with meat dietary protein source and phosphorus homeostasis in chronic kidney disease. Clin J Am Soc Nephrol. 2011 Feb;6(2):257-64. doi: 10.2215/CJN.05040610. Epub 2010 Dec 23. PMID: 21183586; PMCID: PMC3052214.
Scialla JJ, Appel LJ, Wolf M, Yang W, Zhang X, Sozio SM, Miller ER 3rd, Bazzano LA, Cuevas M, Glenn MJ, Lustigova E, Kallem RR, Porter AC, Townsend RR, Weir MR, Anderson CA; Chronic Renal Insufficiency Cohort-CRIC Study Group. Plant protein intake is associated with fibroblast growth factor 23 and serum bicarbonate levels in patients with chronic kidney disease: the Chronic Renal Insufficiency Cohort study. J Ren Nutr. 2012 Jul;22(4):379-388.e1. doi: 10.1053/j.jrn.2012.01.026. Epub 2012 Apr 4. PMID: 22480598; PMCID: PMC3383455.
Kubota M, Watanabe R, Yamaguchi M, Hosojima M, Saito A, Fujii M, Fujimura S, Kadowaki M. Rice endosperm protein slows progression of fatty liver and diabetic nephropathy in Zucker diabetic fatty rats. Br J Nutr. 2016 Oct;116(8):1326-1335. doi: 10.1017/S0007114516003512. Epub 2016 Oct 11. PMID: 27724997.
Fu WJ, Haynes TE, Kohli R, Hu J, Shi W, Spencer TE, Carroll RJ, Meininger CJ, Wu G. Dietary L-arginine supplementation reduces fat mass in Zucker diabetic fatty rats. J Nutr. 2005 Apr;135(4):714-21. doi: 10.1093/jn/135.4.714. PMID: 15795423.
Anderson JW. Beneficial effects of soy protein consumption for renal function. Asia Pac J Clin Nutr. 2008;17 Suppl 1:324-8. PMID: 18296369.
McGraw NJ, Krul ES, Grunz-Borgmann E, Parrish AR. Soy-based renoprotection. World J Nephrol. 2016 May 6;5(3):233-57. doi: 10.5527/wjn.v5.i3.233. PMID: 27152261; PMCID: PMC4848148.
National Kidney Foundation Plant-Based Diet and Kidney Health.
Macnaughton LS, Wardle SL, Witard OC, McGlory C, Hamilton DL, Jeromson S, Lawrence CE, Wallis GA, Tipton KD. The response of muscle protein synthesis following whole-body resistance exercise is greater following 40 g than 20 g of ingested whey protein. Physiol Rep. 2016 Aug;4(15):e12893. doi: 10.14814/phy2.12893. PMID: 27511985; PMCID: PMC4985555.
Rieu I, Balage M, Sornet C, Giraudet C, Pujos E, Grizard J, Mosoni L, Dardevet D. Leucine supplementation improves muscle protein synthesis in elderly men independently of hyperaminoacidaemia. J Physiol. 2006 Aug 15;575(Pt 1):305-15. doi: 10.1113/jphysiol.2006.110742. Epub 2006 Jun 15. PMID: 16777941; PMCID: PMC1819434.
Witard OC, Wardle SL, Macnaughton LS, Hodgson AB, Tipton KD. Protein Considerations for Optimising Skeletal Muscle Mass in Healthy Young and Older Adults. Nutrients. 2016 Mar 23;8(4):181. doi: 10.3390/nu8040181. PMID: 27023595; PMCID: PMC4848650.
Yang Y, Breen L, Burd NA, Hector AJ, Churchward-Venne TA, Josse AR, Tarnopolsky MA, Phillips SM. Resistance exercise enhances myofibrillar protein synthesis with graded intakes of whey protein in older men. Br J Nutr. 2012 Nov 28;108(10):1780-8. doi: 10.1017/S0007114511007422. Epub 2012 Feb 7. PMID: 22313809.
Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA, Phillips SM. Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am J Clin Nutr. 2009 Jan;89(1):161-8. doi: 10.3945/ajcn.2008.26401. Epub 2008 Dec 3. PMID: 19056590.
Tang JE, Moore DR, Kujbida GW, Tarnopolsky MA, Phillips SM. Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J Appl Physiol (1985). 2009 Sep;107(3):987-92. doi: 10.1152/japplphysiol.00076.2009. Epub 2009 Jul 9. PMID: 19589961.
Gorissen SH, Horstman AM, Franssen R, Crombag JJ, Langer H, Bierau J, Respondek F, van Loon LJ. Ingestion of Wheat Protein Increases In Vivo Muscle Protein Synthesis Rates in Healthy Older Men in a Randomized Trial. J Nutr. 2016 Sep;146(9):1651-9. doi: 10.3945/jn.116.231340. Epub 2016 Jul 20. PMID: 27440260.
Mitchell CJ, Churchward-Venne TA, Parise G, Bellamy L, Baker SK, Smith K, Atherton PJ, Phillips SM. Acute post-exercise myofibrillar protein synthesis is not correlated with resistance training-induced muscle hypertrophy in young men. PLoS One. 2014 Feb 24;9(2):e89431. doi: 10.1371/journal.pone.0089431. Erratum in: PLoS One. 210;9(5):e98731. PMID: 24586775; PMCID: PMC3933567.
Hartman JW, Tang JE, Wilkinson SB, Tarnopolsky MA, Lawrence RL, Fullerton AV, Phillips SM. Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am J Clin Nutr. 2007 Aug;86(2):373-81. doi: 10.1093/ajcn/86.2.373. PMID: 17684208.
Volek JS, Volk BM, Gómez AL, Kunces LJ, Kupchak BR, Freidenreich DJ, Aristizabal JC, Saenz C, Dunn-Lewis C, Ballard KD, Quann EE, Kawiecki DL, Flanagan SD, Comstock BA, Fragala MS, Earp JE, Fernandez ML, Bruno RS, Ptolemy AS, Kellogg MD, Maresh CM, Kraemer WJ. Whey protein supplementation during resistance training augments lean body mass. J Am Coll Nutr. 2013;32(2):122-35. doi: 10.1080/07315724.2013.793580. PMID: 24015719.
Messina M, Lynch H, Dickinson JM, Reed KE. No Difference Between the Effects of Supplementing With Soy Protein Versus Animal Protein on Gains in Muscle Mass and Strength in Response to Resistance Exercise. Int J Sport Nutr Exerc Metab. 2018 Nov 1;28(6):674-685. doi: 10.1123/ijsnem.2018-0071. Epub 2018 Oct 26. PMID: 29722584.
Joy JM, Lowery RP, Wilson JM, Purpura M, De Souza EO, Wilson SM, Kalman DS, Dudeck JE, Jäger R. The effects of 8 weeks of whey or rice protein supplementation on body composition and exercise performance. Nutr J. 2013 Jun 20;12:86. doi: 10.1186/1475-2891-12-86. PMID: 23782948; PMCID: PMC3698202.
Babault N, Païzis C, Deley G, Guérin-Deremaux L, Saniez MH, Lefranc-Millot C, Allaert FA. Pea proteins oral supplementation promotes muscle thickness gains during resistance training: a double-blind, randomized, Placebo-controlled clinical trial vs. Whey protein. J Int Soc Sports Nutr. 2015 Jan 21;12(1):3. doi: 10.1186/s12970-014-0064-5. PMID: 25628520; PMCID: PMC4307635.
Banaszek A, Townsend JR, Bender D, Vantrease WC, Marshall AC, Johnson KD. The Effects of Whey vs. Pea Protein on Physical Adaptations Following 8-Weeks of High-Intensity Functional Training (HIFT): A Pilot Study. Sports (Basel). 2019 Jan 4;7(1):12. doi: 10.3390/sports7010012. PMID: 30621129; PMCID: PMC6358922.
Morton RW, Murphy KT, McKellar SR, Schoenfeld BJ, Henselmans M, Helms E, Aragon AA, Devries MC, Banfield L, Krieger JW, Phillips SM. A systematic review, meta-analysis and meta-regression of the effect of protein supplementation on resistance training-induced gains in muscle mass and strength in healthy adults. Br J Sports Med. 2018 Mar;52(6):376-384. doi: 10.1136/bjsports-2017-097608. Epub 2017 Jul 11. Erratum in: Br J Sports Med. 2020 Oct;54(19):e7. PMID: 28698222; PMCID: PMC5867436.
Popova A., Mihaylova D. Antinutrients in Plant-based Foods: A Review. Open Biotechnol. J. 2019;13:68–76. doi: 10.2174/1874070701913010068
Messina M. Soy and Health Update: Evaluation of the Clinical and Epidemiologic Literature. Nutrients. 2016 Nov 24;8(12):754. doi: 10.3390/nu8120754. PMID: 27886135; PMCID: PMC5188409.
Weber KS, Setchell KD, Stocco DM, Lephart ED. Dietary soy-phytoestrogens decrease testosterone levels and prostate weight without altering LH, prostate 5alpha-reductase or testicular steroidogenic acute regulatory peptide levels in adult male Sprague-Dawley rats. J Endocrinol. 2001 Sep;170(3):591-9. doi: 10.1677/joe.0.1700591. PMID: 11524239.
Wu, J., Liu, S., Shen, Xy. et al. Phytoestrogens inhibiting androgen receptor signal and prostate cancer cell proliferation. Chem. Res. Chin. Univ. 29, 911–916 (2013). /s40242-013-3123-6
Bektic J, Berger AP, Pfeil K, Dobler G, Bartsch G, Klocker H. Androgen receptor regulation by physiological concentrations of the isoflavonoid genistein in androgen-dependent LNCaP cells is mediated by estrogen receptor beta. Eur Urol. 2004 Feb;45(2):245-51; discussion 251. doi: 10.1016/j.eururo.2003.09.001. PMID: 14734014.
Genovese MI, Barbosa AC, Pinto Mda S, Lajolo FM. Commercial soy protein ingredients as isoflavone sources for functional foods. Plant Foods Hum Nutr. 2007 Jun;62(2):53-8. doi: 10.1007/s11130-007-0041-0. PMID: 17333396.
European Food Safety Authority Risk assessment for peri- and post-menopausal women taking food supplements containing isolated isoflavones. EFSA J. 2015;13 doi: 10.2903/j.efsa.2015.4246
Hamilton-Reeves JM, Vazquez G, Duval SJ, Phipps WR, Kurzer MS, Messina MJ. Clinical studies show no effects of soy protein or isoflavones on reproductive hormones in men: results of a meta-analysis. Fertil Steril. 2010 Aug;94(3):997-1007. doi: 10.1016/j.fertnstert.2009.04.038. Epub 2009 Jun 12. PMID: 19524224.
Dillingham BL, McVeigh BL, Lampe JW, Duncan AM. Soy protein isolates of varying isoflavone content exert minor effects on serum reproductive hormones in healthy young men. J Nutr. 2005 Mar;135(3):584-91. doi: 10.1093/jn/135.3.584. PMID: 15735098.
Beaton LK, McVeigh BL, Dillingham BL, Lampe JW, Duncan AM. Soy protein isolates of varying isoflavone content do not adversely affect semen quality in healthy young men. Fertil Steril. 2010 Oct;94(5):1717-22. doi: 10.1016/j.fertnstert.2009.08.055. Epub 2009 Oct 12. PMID: 19819436.
Wu J, Zeng R, Huang J, Li X, Zhang J, Ho JC, Zheng Y. Dietary Protein Sources and Incidence of Breast Cancer: A Dose-Response Meta-Analysis of Prospective Studies. Nutrients. 2016 Nov 17;8(11):730. doi: 10.3390/nu8110730. PMID: 27869663; PMCID: PMC5133114.
Zhao TT, Jin F, Li JG, Xu YY, Dong HT, Liu Q, Xing P, Zhu GL, Xu H, Miao ZF. Dietary isoflavones or isoflavone-rich food intake and breast cancer risk: A meta-analysis of prospective cohort studies. Clin Nutr. 2019 Feb;38(1):136-145. doi: 10.1016/j.clnu.2017.12.006. Epub 2017 Dec 15. PMID: 29277346.
Qiu S, Jiang C. Soy and isoflavones consumption and breast cancer survival and recurrence: a systematic review and meta-analysis. Eur J Nutr. 2019 Dec;58(8):3079-3090. doi: 10.1007/s00394-018-1853-4. Epub 2018 Oct 31. PMID: 30382332.
Eakin A, Kelsberg G, Safranek S. Clinical Inquiry: Does high dietary soy intake affect a woman's risk of primary or recurrent breast cancer? J Fam Pract. 2015 Oct;64(10):660-2. PMID: 26551478.
Chi F, Wu R, Zeng YC, Xing R, Liu Y, Xu ZG. Post-diagnosis soy food intake and breast cancer survival: a meta-analysis of cohort studies. Asian Pac J Cancer Prev. 2013;14(4):2407-12. doi: 10.7314/apjcp.2013.14.4.2407. PMID: 23725149.
Rock CL, Doyle C, Demark-Wahnefried W, Meyerhardt J, Courneya KS, Schwartz AL, Bandera EV, Hamilton KK, Grant B, McCullough M, Byers T, Gansler T. Nutrition and physical activity guidelines for cancer survivors. CA Cancer J Clin. 2012 Jul-Aug;62(4):243-74. doi: 10.3322/caac.21142. Epub 2012 Apr 26. Erratum in: CA Cancer J Clin. 2013 May;63(3):215. PMID: 22539238.
VAN WYK JJ, ARNOLD MB, WYNN J, PEPPER F. The effects of a soybean product on thyroid function in humans. Pediatrics. 1959 Nov;24:752-60. PMID: 13841160.
HYDOVITZ JD. Occurrence of goiter in an infant on a soy diet. N Engl J Med. 1960 Feb 18;262:351-3. doi: 10.1056/NEJM196002182620707. PMID: 14405715.
Chang HC, Doerge DR. Dietary genistein inactivates rat thyroid peroxidase in vivo without an apparent hypothyroid effect. Toxicol Appl Pharmacol. 2000 Nov 1;168(3):244-52. doi: 10.1006/taap.2000.9019. PMID: 11042097.
Divi RL, Doerge DR. Inhibition of thyroid peroxidase by dietary flavonoids. Chem Res Toxicol. 1996 Jan-Feb;9(1):16-23. doi: 10.1021/tx950076m. PMID: 8924586.
Otun J, Sahebkar A, Östlundh L, Atkin SL, Sathyapalan T. Systematic Review and Meta-analysis on the Effect of Soy on Thyroid Function. Sci Rep. 2019 Mar 8;9(1):3964. doi: 10.1038/s41598-019-40647-x. PMID: 30850697; PMCID: PMC6408586.
Messina M, Redmond G. Effects of soy protein and soybean isoflavones on thyroid function in healthy adults and hypothyroid patients: a review of the relevant literature. Thyroid. 2006 Mar;16(3):249-58. doi: 10.1089/thy.2006.16.249. PMID: 16571087.
Bell DS, Ovalle F. Use of soy protein supplement and resultant need for increased dose of levothyroxine. Endocr Pract. 2001 May-Jun;7(3):193-4. doi: 10.4158/EP.7.3.193. PMID: 11421567.
Palmer S. Plant Proteins. Today’s Dietit. 2017;19:26–33
Mintel Press Team US Non-Dairy Milk Sales Grow 61% over the Last 5 Years.
Bridges M. Moo-over, cow’s milk: The rise of plant-based dairy alternatives. Pract. Gastroenterol. 2018;171:20–27
McCarthy KS, Parker M, Ameerally A, Drake SL, Drake MA. Drivers of choice for fluid milk versus plant-based alternatives: What are consumer perceptions of fluid milk? J Dairy Sci. 2017 Aug;100(8):6125-6138. doi: 10.3168/jds.2016-12519. Epub 2017 May 24. PMID: 28551193.
Mäkinen OE, Wanhalinna V, Zannini E, Arendt EK. Foods for Special Dietary Needs: Non-dairy Plant-based Milk Substitutes and Fermented Dairy-type Products. Crit Rev Food Sci Nutr. 2016;56(3):339-49. doi: 10.1080/10408398.2012.761950. PMID: 25575046.
O’Connor A. Got Almond Milk? Dairy Farms Protest Milk Label on Nondairy Drinks. The New York Times 2017
NIAID-Sponsored Expert Panel, Boyce JA, Assa'ad A, Burks AW, Jones SM, Sampson HA, Wood RA, Plaut M, Cooper SF, Fenton MJ, Arshad SH, Bahna SL, Beck LA, Byrd-Bredbenner C, Camargo CA Jr, Eichenfield L, Furuta GT, Hanifin JM, Jones C, Kraft M, Levy BD, Lieberman P, Luccioli S, McCall KM, Schneider LC, Simon RA, Simons FE, Teach SJ, Yawn BP, Schwaninger JM. Guidelines for the diagnosis and management of food allergy in the United States: report of the NIAID-sponsored expert panel. J Allergy Clin Immunol. 2010 Dec;126(6 Suppl):S1-58. doi: 10.1016/j.jaci.2010.10.007. PMID: 21134576; PMCID: PMC4241964.
Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, Nadeau K, Nowak-Wegrzyn A, Oppenheimer J, Perry TT, Randolph C, Sicherer SH, Simon RA, Vickery BP, Wood R; Joint Task Force on Practice Parameters, Bernstein D, Blessing-Moore J, Khan D, Lang D, Nicklas R, Oppenheimer J, Portnoy J, Randolph C, Schuller D, Spector S, Tilles SA, Wallace D; Practice Parameter Workgroup, Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, Nadeau K, Nowak-Wegrzyn A, Oppenheimer J, Perry TT, Randolph C, Sicherer SH, Simon RA, Vickery BP, Wood R. Food allergy: a practice parameter update-2014. J Allergy Clin Immunol. 2014 Nov;134(5):1016-25.e43. doi: 10.1016/j.jaci.2014.05.013. Epub 2014 Aug 28. PMID: 25174862.
Gupta RS, Warren CM, Smith BM, Blumenstock JA, Jiang J, Davis MM, Nadeau KC. The Public Health Impact of Parent-Reported Childhood Food Allergies in the United States. Pediatrics. 2018 Dec;142(6):e20181235. doi: 10.1542/peds.2018-1235. Epub 2018 Nov 19. Erratum in: Pediatrics. 2019 Mar;143(3): PMID: 30455345; PMCID: PMC6317772.
Gupta RS, Warren CM, Smith BM, Jiang J, Blumenstock JA, Davis MM, Schleimer RP, Nadeau KC. Prevalence and Severity of Food Allergies Among US Adults. JAMA Netw Open. 2019 Jan 4;2(1):e185630. doi: 10.1001/jamanetworkopen.2018.5630. PMID: 30646188; PMCID: PMC6324316.
Taylor S.L. Food Allergies-a Challenge for cuRrent and Emerging Proteins.
Koeberl M, Sharp MF, Tian R, Buddhadasa S, Clarke D, Roberts J. Lupine allergen detecting capability and cross-reactivity of related legumes by ELISA. Food Chem. 2018 Aug 1;256:105-112. doi: 10.1016/j.foodchem.2018.02.043. Epub 2018 Feb 9. PMID: 29606424.
Jappe U, Vieths S. Lupine, a source of new as well as hidden food allergens. Mol Nutr Food Res. 2010 Jan;54(1):113-26. doi: 10.1002/mnfr.200900365. PMID: 20013885.
NC Soybean Producers Association History of Soybeans.
Juan I. Egaña, Angel Fuentes, Fred H. Steinke, Ricardo Uauy, Protein quality comparison of a new isolated soy protein and milk in chilean preschool children, Nutrition Research, Volume 3, Issue 2, 1983, Pages 195-202, ISSN 0271-5317,
Kay T, Ifeacho CL, Onowu G, Udenze V, Nnamani G, Anazonwu-Bello JN, Ifenu F, Modebe V, Emembolu M. Use of soya bean to improve the protein content of the diet in West Africa and thus prevent kwashiorkor. J Trop Pediatr Environ Child Health. 1975 Feb;21(1-B):45-8. PMID: 1039343.
Mathew A., Raut D.S. Effect of soyamilk on the growth of malnourished children admitted to hospital wards. Indian J. Nutr. Diet. 1981;18:260–267
Savage JH, Kaeding AJ, Matsui EC, Wood RA. The natural history of soy allergy. J Allergy Clin Immunol. 2010 Mar;125(3):683-6. doi: 10.1016/j.jaci.2009.12.994. PMID: 20226303.
Cordle CT. Soy protein allergy: incidence and relative severity. J Nutr. 2004 May;134(5):1213S-1219S. doi: 10.1093/jn/134.5.1213S. PMID: 15113974.
Vierk KA, Koehler KM, Fein SB, Street DA. Prevalence of self-reported food allergy in American adults and use of food labels. J Allergy Clin Immunol. 2007 Jun;119(6):1504-10. doi: 10.1016/j.jaci.2007.03.011. Epub 2007 Apr 23. PMID: 17451802.
FARE Food Allergy Research & Education Soy Allergy
Gupta RS, Springston EE, Warrier MR, Smith B, Kumar R, Pongracic J, Holl JL. The prevalence, severity, and distribution of childhood food allergy in the United States. Pediatrics. 2011 Jul;128(1):e9-17. doi: 10.1542/peds.2011-0204. Epub 2011 Jun 20. PMID: 21690110.
Soller L, Ben-Shoshan M, Harrington DW, Fragapane J, Joseph L, St Pierre Y, Godefroy SB, La Vieille S, Elliott SJ, Clarke AE. Overall prevalence of self-reported food allergy in Canada. J Allergy Clin Immunol. 2012 Oct;130(4):986-8. doi: 10.1016/j.jaci.2012.06.029. Epub 2012 Aug 3. PMID: 22867693.
American College of Allergy, Asthma, and Immunology Milk and Dairy Allergy.
Eggesbø M, Botten G, Halvorsen R, Magnus P. The prevalence of allergy to egg: a population-based study in young children. Allergy. 2001 May;56(5):403-11. doi: 10.1034/j.1398-9995.2001.056005403.x. PMID: 11350303.
Sicherer SH, Sampson HA. 9. Food allergy. J Allergy Clin Immunol. 2006 Feb;117(2 Suppl Mini-Primer):S470-5. doi: 10.1016/j.jaci.2005.05.048. PMID: 16455349.
American College of Allergy, Asthma, and Immunology Soy Allergy.
Nowak-Wegrzyn A, Conover-Walker MK, Wood RA. Food-allergic reactions in schools and preschools. Arch Pediatr Adolesc Med. 2001 Jul;155(7):790-5. doi: 10.1001/archpedi.155.7.790. PMID: 11434845.
Soy Nutrition Institute Soy Connection Fact Sheet: Soyfoods + Infants, Children, & Adolescents.
Shewry PR, Beaudoin F, Jenkins J, Griffiths-Jones S, Mills EN. Plant protein families and their relationships to food allergy. Biochem Soc Trans. 2002 Nov;30(Pt 6):906-10. doi: 10.1042/bst0300906. PMID: 12440943.
Shewry P.R., Pandya M.J. The 2S albumin storage proteins. In: Shewry P.R., Casey R., editors. Seed Proteins. Springer; New York, NY, USA: 1999.
Carbonero P., Garcia-Olmedo F. A multigene family of trypsin/a-amylase inhibitors from cereals. In: Shewry P.R., Casey R., editors. Seed Proteins. Springer; New York, NY, USA: 1999. pp. 617–633.
Douliez J.P., Michon T., Elmorjani K., Marion D. Mini Review: Structure, Biological and Technological Functions of Lipid Transfer Proteins and Indolines, the Major Lipid Binding Proteins from Cereal Kernels. J. Cereal Sci. 2000;32:1–20. doi: 10.1006/jcrs.2000.0315.
Rahman S, Jolly CJ, Skerritt JH, Wallosheck A. Cloning of a wheat 15-kDa grain softness protein (GSP). GSP is a mixture of puroindoline-like polypeptides. Eur J Biochem. 1994 Aug 1;223(3):917-25. doi: 10.1111/j.1432-1033.1994.tb19069.x. PMID: 8055969.
Baud F, Pebay-Peyroula E, Cohen-Addad C, Odani S, Lehmann MS. Crystal structure of hydrophobic protein from soybean; a member of a new cysteine-rich family. J Mol Biol. 1993 Jun 5;231(3):877-87. doi: 10.1006/jmbi.1993.1334. PMID: 8515457.
University of Nebraska-Lincoln Allergen Online: Home of the FARRP Allergen Database.
Lu ZX, He JF, Zhang YC, Bing DJ. Composition, physicochemical properties of pea protein and its application in functional foods. Crit Rev Food Sci Nutr. 2020;60(15):2593-2605. doi: 10.1080/10408398.2019.1651248. Epub 2019 Aug 20. PMID: 31429319.
Lavine E, Ben-Shoshan M. Anaphylaxis to hidden pea protein: A Canadian pediatric case series. J Allergy Clin Immunol Pract. 2019 Jul-Aug;7(6):2070-2071. doi: 10.1016/j.jaip.2019.02.010. Epub 2019 Feb 19. PMID: 30794967.
Wensing M, Knulst AC, Piersma S, O'Kane F, Knol EF, Koppelman SJ. Patients with anaphylaxis to pea can have peanut allergy caused by cross-reactive IgE to vicilin (Ara h 1). J Allergy Clin Immunol. 2003 Feb;111(2):420-4. doi: 10.1067/mai.2003.61. PMID: 12589366.
Messina, Mark PhD, MS; Venter, Carina PhD, RD Recent Surveys on Food Allergy Prevalence, Nutrition Today: 1/2 2020 - Volume 55 - Issue 1 - p 22-29 doi: 10.1097/NT.0000000000000389
Skypala IJ. Food-Induced Anaphylaxis: Role of Hidden Allergens and Cofactors. Front Immunol. 2019 Apr 3;10:673. doi: 10.3389/fimmu.2019.00673. PMID: 31001275; PMCID: PMC6457317.